Физические и химические свойства этиленгликоля, формула
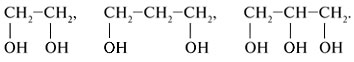
Физические и химические свойства этиленгликоля, формула
Урок 20. Многоатомные спирты
Многоатомные спирты – это органические соединения, в молекулах которых содержатся две или более гидроксильных групп, соединенных с углеводородным радикалом.
Группы ОН в многоатомных спиртах размещаются у разных атомов углерода:
Соединения с двумя группами ОН при одном атоме углерода неустойчивые. Они отщепляют воду и превращаются в альдегиды:
Соединения с двумя группами ОН при соседних атомах углерода называют гликолями (или диолами).
Гликоли получают окислением алкенов в водной среде. Например, при действии перманганата калия или кислорода воздуха в присутствии серебряного катализатора алкены превращаются в двухатомные спирты:
Другой способ получения многоатомных спиртов – гидролиз галогенпроизводных углеводородов:
На производстве глицерин получают по схеме:
Физические свойства
Этиленгликоль и глицерин – бесцветные вязкие жидкости со сладким вкусом (от греч. – сладкий). Растворимость в воде – неограниченная. Температуры кипения этиленгликоля – 197,2 °С, глицерина – 290 °С. Этиленгликоль – яд.
Химические свойства
Этиленгликоль и глицерин подобны одноатомным спиртам.
Так, они реагируют с активными металлами:
Многоатомные спирты в реакции с галогеноводородами обменивают одну или несколько гидроксильных групп ОН на атомы галогена:
Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно-, ди- и тринитроглицериды:
Качественная реакция многоатомных спиртов, позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В щелочной среде при достаточной концентрации глицерина гoлyбой осадок Cu(OH)2 растворяется с образованием раствора ярко-синего цвета – гликолята меди(II):
Применение многоатомных спиртов
УПРАЖНЕНИЯ.
1. Подчеркните структурные формулы многоатомных спиртов:
СlСН2СН2Сl, НОС3Н7, НОСН2СН2ОН, С2Н6О2,
2. По названиям веществ составьте их структурные формулы:
а) этандиол-1,2; б) этиленгликоль; в) пропандиол-1,2, г) пропандиол-1,3;
д) глицерин; е) бутантриол-1,2,4.
3. Составьте уравнения реакций получения этиленгликоля из:
а) этилена; б) 1,2-дибромэтана.
4. Укажите пять областей применения многоатомных спиртов (этиленгликоля и глицерина).
5. Напишите уравнения реакций для цепочки химических превращений, назовите органические вещества:
6. Составьте цепочку химических превращений получения двухатомного спирта
СН3СНОНСН2ОН из алкана С3Н8. Используйте схему:
предельный углеводород моногалогенуглеводород непредельный углеводород дигалогенуглеводород двухатомный спирт.
Ответы на упражнения к теме 2
1. Подчеркнуты структурные формулы многоатомных спиртов:
2. Структурные формулы, составленные по названиям веществ:
3. Реакции получения этиленгликоля:
4. Пять областей применения многоатомных спиртов.
Этиленгликоль (ЭГ) – в антифризах, 66%-й ЭГ замерзает при –60 °C;
в синтезе лавсана [–СН2СН2О(О)СС(О)O–]n;
растворитель (tкип = 198 °С).
Глицерин – в парфюмерии, косметике, медицине – растворитель, компонент мазей;
для производства тринитроглицерина – взрывчатого вещества и лекарства, расширяющего сосуды.
5. Реакции для цепочки химических превращений:
6. Цепочка химических превращений алкана С3Н8 в пропиленгликоль СН3СНОНСН2ОН через промежуточные вещества заданных классов:
ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ
Екатеринбург 2016
Содержание
— Понятие об Спиртах
— Применение спиртов в промышленности
Введение
СПИРТЫ (алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами)
Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу.
1. В зависимости от количества гидроксильных групп в молекуле спирты делят на:
а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
б) многоатомные (две и более гидроксильных групп), например, этиленгликоль
HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4.
Многоатомные спирты
Многоатомными являются спирты, содержащие две и более гидроксильные группы в составе молекулы органического вещества. Все двухатомные спирты называются гликолями.
Этиленгликоль
Этиленгликоль (тривиальное название) или этандиол (систематическое название). Химическая формула HO−CH2CH2−OHHO−CH2CH2−OH.
Двухатомный спирт, простейший представитель многоатомных спиртов. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. Этиленгликоль — горючее вещество. Температура вспышки паров 120 градусов C.
Этиленгликоль находит широкое применение в технике в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Используется в органическом синтезе.
ПОЛУЧЕНИЕ ЭТИЛЕНГЛИКОЛЯ
В промышленности этиленгликоль получают путём:
· (I) гидратацией 1,2-дихлорэтана;
· (II) гидратацией хл opгидринов;
· (III) гидратации окиси этилена при повышенном давлении и температуре в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90 % выхода;
· (IV) окислением этилена перманганатом калия:
ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ
Этиленгликоль обладает всеми свойствами гликолей.
1. Взаимодействие с щелочными металлами: образует соли гликоляты
В отличие от одноатомных спиртов, многоатомные взаимодействуют также и соснованиями. Качественным реактивом на многоатомные спирты является щелочной раствор гидроксида меди(II), при взаимодействии с которым многоатомные спирты образуют комплексное соединение с медью ярко-синего цвета.
2. Взаимодействие с органическими кислотами: образует -одно- и двухзамещенные сложные эфиры (аналогично глицерину)
3. Взаимодействие с галогеноводородами HHal: образует этиленгалогенгидрины
HOCH2CH2OH+HHal⟶HOCH2CH2Hаl+H2O
4. Дегидратация при нагревании в присутствии концентрированной серной кислоты: образуется ацетальдегид 5. Окисление в зависимости от условий и окислителя: могут образовываться
· глиоксалевая и щавелевая кислоты;
Окисление молекулярным кислородом приводит к образованию формальдегида HCOH и муравьиной кислоты HCOOH.
Глицерин
Глицерин(тривиальное название) или пропантриол-1,2,3 (название по систематической номенклатуре).
Трехатомный спирт,входящий в состав сложных эфиров природного происхождения — жидких и твердых жиров.
Бесцветная вязкая жидкость, за счет наличия водородных связей смешивается с водой в любых отношениях. Безводный глицерин очень гигроскопичен, при попадании на кожу вызывает ожоги, но в разбавленном состоянии используется при изготовлении косметических средств (кремов, гелей), и даже в пищевой промышленности для приготовления ликеров.
Получение глицерина
Глицерин получают гидролизом жиров, а также из пропилена (через получение 2,3-гидроксипропановой кислоты с последующим ее восстановлением):
Этиленгликоль — простейший двухатомный спирт ряда гликолей, впервые син-тезированный Вюрцем в 1859 г. В промышленных масштабах эти-ленгликоль начали получать в Германии в период первой мировой войны. В настоящее время этиленгликоль (а также диэтиленгликоль и полиэтиленгликоли) выpaбатывают в очень больших коли-чествах и используют в различных отраслях народного хозяйства.
Будучи весьма гигроскопичным, этиленгликоль в то же время хорошо растворяет смолы, красители и некоторые вещества расти-тельного происхождения. Благодаря сочетанию этих свойств этиленгликоль применяется при крашении тканей, в ситцепечатании, для приготовления штемпельных красок и косметических препара-тов, для увлажнения табака и т. д. Этиленгликоль является также важным полупродуктом в производстве синтетических смол, рас-творителей, взрывчатых веществ и пр.
Физические свойства
Этиленгликоль СН2ОН—СН2ОН — вязкая бесцветная жидкость со слабым запахом и сладким вкусом. Температура кипения 197° С. Температуры кипения гликолей значительно выше температуры кипения спиртов, что является следствием усиления ассоциации молекул (образования водородных связей) из-за наличия в гликолях двух гидроксильных групп. Температура плавления —11,5° С. Плотность 1,11г/см 3 ; теплота парообразования 191 ккал/кг. Смешивается во всех отношениях с во-дой, глицерином, одноатомными алифатическими спиртами, ацетоном, ледяной уксусной кислотой, пиридином и фурфуролом; не смешивается с бензолом, кси-лолом, толуолом, хлорбензолом, хлороформом, четыреххлористым углеродом. Этиленгликоль обладает токсическим действием, сходным с действием метило-вого спирта.
Читать еще: Как почистить сосуды в домашних условиях от тромбов, бляшек, холестерина. Народные и медикаментозные средстваЭтиленгликоль сравнительно устойчив при высокой темпера-туре — не разлагается при пропускании над пемзой, нагретой до 400°С. Разложение гликоля начинается при 500 — 520°С, а при 550°С происходит уже со значительной скоростью; но даже при этой температуре до 36% этиленгликоля не подвергается разло-жению.
Важным свойством этиленгликоля является его способность сильно понижать температуру замерзания воды. Водный раствор, содержащий 40 объемных % этиленгликоля, замерзает при —25°С, а 60%-ный водный раствор при — 40°С. Поэтому этиленгликоль с успехом применяется для приготовления антифризов.
Химические свойства этиленгликоля, как и других гликолей аналогичны свойствам одноатомных спиртов. Однако у гликолей могут вступать в реакции как одна, так и обе гидроксильные группы.
1. С щелочными металлами гликоли образуют полный и неполный гликоляты: CH2ONa — CH2ONa, CH2OH — CH2ONa.
Гликоляты образуются не только со щелочными металлами, но и с оксидами некоторых других металлов, например с гидроксидом меди. При действии щелочи на сульфат меди (II) образуется гoлyбой осадок гидроксида меди (II). Этот осадок не растворяется в спирте, но очень легко на холоде растворяется в гликоле вследствие образования комплексного гликолята меди:
2. С минеральными и органическими кислотами получаются полные и неполные эфиры. Например, в приведенной реакции образуются непол-ный и полный эфиры этиленгликоля и азотной кислоты — нитраты:
Соответственно можно получить полные и неполные простые эфиры, например диэтиловый эфир этилен гликоля C2Н5ОСН2 — СН2ОС2Н5 и моноэтиловый эфир СН2ОН — СН2ОС2Н5 . Последний под названием этилцеллозольв применяется как растворитель в производстве нитрола-ков, бездымного пороха (пироксилина), ацетатного шелка и других произ-водных целлюлозы.
С двуосновными кислотами этиленгликоль ступает реакцию поликонденсации, образуя высокомолекулярные полиэфиры
3. Окисление гликолей проходит сложно, ступенчато:
О СН2OH — СООН > НООС — С — Н
СН2OH С — С СООН
4. Отщепление воды от этиленгликоля может иметь внутримолекулярный и межмолекулярный хаpaктер. Направление отщепления воды зависит от условий реакции. Пример внутримолекулярного выделения воды:
Межмолекулярное выделение воды приводит к образованию оксиэфиров (спиртоэфиров) или циклических простых эфиров:
При межмолекулярной дегидратации этиленгликоля могут быть получены зависимости от условий диэтиленгликоль или диоксан:
Способы получения этиленгликоля
В промышленном масштабе этиленгликоль получают главным образом гидратацией окиси этилена:
При гидратации окиси этилена, кроме этиленгликоля, образу-ются ди-, три-, тетра- и полиэтиленгликоли. Чтобы уменьшить образование полигликолей, гидратацию проводят с большим избытком воды (на 1 моль окиси этилена берут от 10 до 22 моль воды) и добавляют к водному раствору окиси этилена 0,1—0,5% кислоты. В этих условиях получается этиленгликоль, содержащий лишь немного диэтиленгликоля и следы высших полиэтиленгликолей.
Процесс проводят в жидкой фазе в присутствии катализаторов (небольшое количество кислоты — серной, фосфорной или щавеле-вой) при 50—100°С и атмосферном давлении или без катализа-тора — при 10 ат и 190—200° С.
Гидратацию окиси этилена при атмосферном давлении можно проводить, обpaбатывая раствором кислоты контактные газы про-цесса прямого окисления этилена. Получаемый разбавленный раствор этиленгликоля нейтрализуют, отгоняют большую часть воды и далее фpaкционной перегонкой удаляют остатки воды и высшие гликоли.
В отсутствие катализаторов гидратацию окиси этилена проводят обычно под давлением 10 ат. при мольном соотношении окиси этилена и воды примерно 1 : 16; продолжительность контакта 30 мин. Раствор гликолей упаривают в многокорпусном выпарном аппарате до содержания воды около 15% и далее подвергают рек-тификации. Соковый пар из последнего аппарата конденсируют и конденсат, содержащий 0,5—1,0% этиленгликоля, возвращают на гидратацию свежей окиси этилена. На 1 т этиленгликоля получается примерно 120 кг диэтиленгликоля и 30 кг триэтилен- гликоля.
Общий выход гликолей (считая на окись этилена) при получе-нии их методом гидратации превышает 90%.
Химические свойства этиленгликоля, формула и класс вещества, применение в автомобиле
Глицерин и этиленгликоль ( ethylene glycol) являются самыми известными химическими веществами, которые применяют в различных сферах деятельности. Их исследование несколько веков назад показало, что схожих веществ не существует. Многоатомные спирты используют и в химических синтезах, и в отраслях промышленности, и в сферах человеческой деятельности.
Однако эти вещества имеют и отрицательные качества. Поэтому стоит тщательно разобрать состав этиленгликоля, его формулу и степень опасности для человека.
Что такое этиленгликоль
По определению этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2) — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель многоатомных спиртов. Если вещество очищено, то представляет собой прозрачную бесцветную жидкость маслянистой консистенции.
Изначально этиленгликоль использовался во времена Первой мировой войны в качестве глицерина. Однако со временем изменил свое направление. Его стали использовать в различных сферах химической промышленности.
Формула и класс вещества
Химическая формула гликоля — C2H6O2, рациональная — C2H4 (OH) 2, структурная — HO—CH2—CH2—OH . В основе молекулы лежит непредельный скелет этилена, который состоит из двух атомов карбона. На свободные валентные места присоединились две гидроксильные группы.
У этиленгликоля есть несколько названий, которые зачастую встречаются в составе продуктов химического производства:
Молекула имеет подобие трaнc-конфигурации в размещении гидроксильных групп. Такое расположение соответствует самому удаленному расположению водородов, что дает максимальную устойчивость системы.
Как получают
Массовое получение 1.2-этандиола началось еще в тридцатые годы прошлого века. Сначала получали лишь одним методом, потом появились новые. Таким образом, гликоль можно получить несколькими способами, однако некоторые из них стали частью истории, а другие превзошли их качеством.
Изначально 1,2-диоксиэтан получали из дибромэтана. Двойная связь этилена разрывается, а свободные валентности занимаются галогенами — исходным веществом в данной реакции. Образование промежуточного соединения возможно благодаря замещению ацетатными группами, которые при гидролизе превращаются в спиртовые.
С улучшением технологий появился новый метод — получение этиленгликоля прямым гидролизом любых этанов и этиленов , которые замещены двумя галогенами соседних атомов карбона. С помощью различных водных растворов, карбонатов металлов, воды и диоксида свинца начинается реакция, которая возможна лишь при больших температурах и давлении. Побочные вещества — диэтиленгликоль и триэтиленгликоль.
Следующий способ позволил получать 1,2-диоксиэтан из эфира этиленхл opгидрина путем его гидролиза угольными солями. При 170 градусах выход целевого продукта достигал 90 %. Однако был значительный недостаток — гликоль необходимо извлекать из раствора соли. Ученые решили эту проблему. Они разбили процесс на две стадии, при этом оставив то же исходное вещество.
Гидролиз этиленгликоль ацетатов стал отдельным способом, когда получилось добыть исходный реагент путем окисления этилена в уксусной кислоте кислородом.
Читать еще: Омега 3 – источники и профилактика холестерина
1,2-диоксиэтан не имеет запаха, однако, имеет сладковатый вкус. Относят к умеренно токсичным легковоспламеняющимся веществам. Легко соединяется с водой. Это используют в промышленности, так как температура замерзания таких веществ очень низкая.
Физические
Еще в прошлом веке стало известно, что этиленгликоль обладает уникальными свойствами.
- температура возгорания составляет от +112 ˚С до +124 ˚С;
- самовоспламениться может при нагреве до +380 ˚С;
- чистый этиленгликоль замерзает при -12 ˚С;
- раствор на водной основе может замерзать при температуре ниже -65 ˚С, а при более низком значении начинается образование кристаллов льда;
- точка кипения чистой жидкости достигается при +121 ˚С;
- плотность — 11,114 г/см³.
Такие хаpaктеристики дают возможность применять 1,2-диоксиэтан в различных сферах производства.
Химические
Вещество имеет несколько названий, но все они означают одно и то же. Собственно, и химические свойства у них одинаковы. Если массовая доля вещества достигает 99.8%, то оно высшего сорта.
Список химических свойств:
- молярная масса — 62,068 г/моль;
- коэффициент оптического преломления — 1,4318;
- константа диссоциации кислоты — 15,1±0,1;
- умеренно токсичный.
1.2-этандиол относят к третьей группе опасности, поэтому предельно допустимые концентрации в атмосфере по ГОСТу могут быть не более 5 миллиграмм/м³.
Применение
Этиленгликоль нашел свое призвание во многих отраслях. Незаменимым веществом является и в автомобилестроении. Его уникальные свойства позволяют создать высококачественные жидкости.
Может регенерировать исходное карбонильное соединение в присутствии воды и кислоты:
- Как компонент противоводокристаллизационной жидкости «И».
- В качестве криопротектора.
- Для поглощения воды, предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путем осушения и удаления солей.
- Этиленгликоль является исходным сырьем для производства взрывчатого вещества нитрогликоля.
1,3-диоксоланы могут быть получены при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана. Такие соединения устойчивы к действию нуклеофилов и оснований.
В автомобилях
Благодаря своей дешевизне этиленгликоль нашел широкое применение в технике.
Он может быть использован:
- как компонент тормозных жидкостей и автомобильных антифризов;
- как теплоноситель с содержанием не более 50 % в системах отопления;
- в качестве теплоносителя в виде раствора в автомобилях и системах жидкостного охлаждения компьютеров;
- в производстве полиуретанов, целлофана и ряда других полимеров;
- как растворитель красящих веществ;
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путем получения 1,3-диоксолана.
Наиболее известное его направление — компонент автомобильных антифризов. Эта отрасль составляет 60 % его потрeбления. Такие смеси могут не замерзать при низких температурах, а также коррозийно устойчивы.
В других отраслях
Кроме того 1,2-диоксиэтан является незаменим и в других отраслях промышленности.
1.2-этандиол также применяется:
- при производстве конденсаторов;
- при производстве 1,4-диоксана, пропиленгликоля;
- как теплоноситель в системах чиллер-фанкойл;
- в качестве компонента крема для обуви;
- в составе для мытья стекол вместе с изопропиловым спиртом;
- при криоконсервировании биологических объектов в качестве криопротектора;
- при производстве полиэтилентерефталата, пластика.
И хотя 1,2-диоксиэтан применяют в других отраслях, их процент применения довольно мал.
Вред для человека
Однако 1.2-этандиол имеет и свои минусы. Неряшливое или неаккуратное его использование может привести к трагическим последствиям.
Класс опасности вещества
Класс опасности этиленгликоля — третья группа, то есть его контакт с окружающей средой должен быть как можно меньше. Если же 1.2-этандиол попадает в организм человека, в нем могут развиться необратимые негативные явления. При однократном употрeблении внутрь 100 и более миллилитров наступает летальный исход.
Пары данного вещества же менее токсичны, однако систематическое вдыхание может привести к гибели. Если человек отравляется гликолем, ему следует принять препарат, который содержит 4-метилпиразол.
Симптомы отравления
В воспалительный процесс вовлекаются все системы органов. Скрытый период отравления этиленгликолем обычно равен 12 часам, но сроки могут изменяться в зависимости от количества употрeбленного спирта.
- Первый период проявляется всего несколько часов, но не более 12. Хаpaктеризуется легким опьянением. Появляется незначительная слабость и невнятная речь, но в целом самочувствие нормальное. В редких случаях беспокоит тошнота, периодическая рвота и боли в животе. От отравленного человека исходит сладковатый запах.
- Через 12 часов после отравления возникает головокружение и головные боли, жажда и тошнота. Появляется рвота, сильнейшие боли в желудке, боль в пояснице и мышцах.
- Немного позже появляются признаки поражения нервной системы: возбуждение и потеря сознания, многочисленные судороги, повышается температура тела. Отравление этиленгликолем проявляется нарушением работы сердца и сосудов: увеличивается частота биения, снижается артериальное давление.
- Нарушается работа дыхательной системы: постепенно появляется одышка, поверхностное дыхание и отек легких. Тяжелые больные теряют сознание.
- Приблизительно на пятые сутки развивается нарушение в работе печени и почек. Из-за почечной недостаточности возможен летальный исход в течение одной недели.
- Если произошло острое отравление, то наступает cмepть из-за паралича дыхательного центра и отека легких.
Легкое отравление возможно при вдыхании паров 1.2-этандиола. Симптомами являются легкая тошнота, слабость.
Меры предосторожности при работе с этиленгликолем
Этиленгликоль является горючем веществом. Температурные пределы воспламенения паров в воздухе начинаются от 112 и заканчиваются 124 °С. Пределы воспламенения паров в воздухе от нижнего до верхнего — 3,8‒6,4 % от объема.
Летальная доза при однократном перopaльном употрeблении — 100‒300 мл этиленгликоля. Имеет относительно низкую летучесть при нормальной температуре. Опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. П ри отравлении следует принять препараты, содержащие этанол или 4-метилпиразол.
Видео о получении вещества
В следующем видео расскажут о получении гликоля.
Этиленгликоль – двухатомный спирт для высококачественных антифризов
Этиленгликоль (1,2-этандиол, 1,2-диоксиэтан, гликоль) является базовым веществом для изготовления различных антифризов, которые используются в системах охлаждения двигателей трaнcпортных средств.
Этиленгликоль – токсичный двухатомный спирт
Химическая формула данного простейшего многоатомного спирта – С2Н6О2 (иначе ее можно записать следующим образом – НО–СН2–СН2–ОН). Этиленгликоль имеет слегка сладковатый вкус, не имеет запаха, в очищенном состоянии выглядит, как немного маслянистая бесцветная прозрачная жидкость.
Так как он причислен к токсичным соединениям (по общепринятой классификации – третий класс опасности), следует избегать попадания данного вещества (в растворах и в чистом виде) в организм человека. Основные химические и физические свойства 1,2-диоксиэтана:
- молярная масса – 62,068 г/моль;
- коэффициент оптического преломления – 1,4318;
- температура воспламенения – 124 градуса (верхний предел) и 112 градусов (нижний предел) ;
- температура самовоспламенения – 380 °С;
- температура замерзания (стопроцентный гликоль) – 22 °С;
- температура кипения – 197,3 °С;
- плотность – 11,113 г/кубический сантиметр.
Пары описываемого двухатомного спирта вспыхивают в тот момент, когда его температура достигает 120 градусов. Еще раз напомним, что 1,2-этандиол имеет 3-й класс опасности. А это означает, что его предельно допустимые концентрации в атмосфере могут быть не более 5 миллиграмм/кубический метр. Если же этиленгликоль попадает в организм человека, в нем могут развиться необратимые негативные явления, которые способны привести к cмepти. При однократном употрeблении вовнутрь 100 и более миллилитров гликоля наступает летальный исход.
Читать еще: При каких обстоятельствах можно отравиться груздями и как такое отравление лечить?
Пары данного соединения менее токсичны. Так как этиленгликоль хаpaктеризуется сравнительно малым показателем летучести, реальная опасность для человека возникает тогда, когда он систематически вдыхает пары 1,2-этандиола. О том, что есть вероятность отравления парами (либо туманами) рассматриваемого соединения, сигнализирует кашель и раздражение слизистой оболочки. Если человек отравляется гликолем, ему следует принять препарат, содержащий 4-метилпиразол (мощный антидот, подавляющий фермент алкогольдегидрогеназы), или этанол (одноатомный этиловый спирт).
Применение гликоля в разных областях техники
Малая себестоимость данного многоатомного спирта, его особые химические и физические свойства (плотность и другие) привели к тому, что он используется весьма широко в различных технических сферах.
Любой автомобилист знает, что представляет собой обычная охлаждающая жидкость для его «железного коня» под названием антифриз – этиленгликоля 60 % + воды 40 %. Такая смесь хаpaктеризуется температурой замерзания -45 градусов, очень трудно найти более подходящую жидкость для автомобильных систем охлаждения, несмотря даже и на высокий класс опасности 1,2-этандиола.
В автомобильной отрасли этиленгликоль находит применение и в качестве отличного теплоносителя. Кроме того, он используется в следующих сферах:
- органический синтез: химические свойства гликоля позволяют с его помощью защищать изофорон и другие карбонильные группы, использовать спирт в виде эффективного растворителя, работающего при повышенных температурах, а также в качестве основной составляющей специальной авиационной жидкости, уменьшающей явление обводнения горючих смесей для летательных аппаратов;
- растворение красящих соединений;
- изготовление нитрогликоля – мощного взрывчатого вещества на основе описываемого нами соединения;
- газодобывающая промышленность: гликоль не позволяет формироваться гидрату метана на трубах, кроме того, он поглощает излишнюю влагу на трубопроводах.
Нашел этиленгликоль применение и в качестве эффективного криопротектора. Его используют для производства кремов для обуви, в качестве важного элемента жидкостей для охлаждения компьютерной техники, при изготовлении 1,4-диоксина и разных видов конденсаторов.
Некоторые нюансы производства гликоля
В конце 1850-х годов химик из Франции Вюрц получил этиленгликоль из его диацетата, а чуть позже путем гидратации этиленоксида. Но в то время пpaктического применения новое вещество нигде не нашло. Лишь в 1910-х годах его начали использовать при изготовлении взрывчатых соединений. Плотность гликоля, его иные физические свойства и дешевизна производства обусловили то, что им заменили глицерин, который применялся до этого.
Особые свойства 1,2-этандиола по достоинству оценили американцы. Именно они наладили в середине 1920-х его промышленное изготовление на специально построенном и оборудованном заводе в Западной Вирджинии. В последующие годы гликоль использовали почти все известные на то время компании, занимавшиеся производством динамита. В настоящее время интересующее нас соединение, которое имеет третий класс опасности, изготавливается по технологии гидратации окиси этилена. Существует два варианта его производства:
- с участием ортофосфорной либо серной кислоты (до 0,5 процентов) при температуре от 50 до 100 °С и давлении в одну атмосферу;
- при температуре около 200 °С и давлении в десять атмосфер.
В результате реакции гидратации образуется до 90 процентов чистого 1,2-диоксиэтана, некоторое количество полимергомологов и триэтиленгликоля. Второе соединение добавляют в гидравлические и тормозные жидкости, оно применяется в промышленных системах охлаждения воздуха, из него делают препараты для дезинфекции, а также пластификаторы.
Важнейшие требования ГОСТ 19710 к готовому гликолю
С 1984 года действует ГОСТ 19710, который устанавливает требования к тому, какие свойства (температура замерзания, плотность и так далее) должен иметь этиленгликоль, используемый на предприятиях автомобилестроения и в других отраслях народного хозяйства, где на его основе выпускают разнообразные составы.
По ГОСТ 19710 гликоль (как жидкость) может быть двух типов: первого сорта и высшего сорта. Доля (массовая) воды в гликоле первого сорта должна быть до 0,5 %, высшего – до 0,1 %, железа – до 0,00005 и 0,00001 %, кислот (в пересчете на уксусную кислоту) – до 0,005 и 0,0006 %. Остаток после прокаливания готового продукта не может быть более 0,002 и 0,001 %.
Цвет 1,2-диоксиэтана по ГОСТ 19710 (по шкале Хазена):
- после кипячения в растворе кислоты (соляной) – 20 единиц для продукции высшего сорта (первый сорт не нормируется по цвету) ;
- в стандартном состоянии – 5 (высший сорт) и 20 единиц (первый сорт).
В Государственном стандарте 19710 выдвигаются специальные требования к процессу производства описываемого простейшего спирта:
- используется исключительно герметичная аппаратура и оборудование;
- производственное помещение обязательно оснащается вентиляцией, рекомендованной для работы с соединениями, которым присвоен третий класс опасности;
- при попадании гликоля на оборудование или землю его следует сразу же обильно смывать водной струей;
- персонал, работающий в цеху по производству 1,2-этандиола, обеспечивается противогазом модели «БКФ» либо иным приспособлением для защиты органов дыхания, соответствующим ГОСТ 12.4.034;
- возгорания гликоля тушат при помощи инертных газов, специальных пенных составов, а также тонкораспыленной воды.
Готовая продукция по ГОСТ 19710 проверяется различными методами. Например, массовая часть двухатомного спирта и диэтиленгликоля устанавливается способом изотермической газовой хроматографии по технологии так называемого «внутреннего эталона». При этом используются весы для лабораторных исследований (ГОСТ 24104), стеклянная или стальная газохроматографическая колонка и хроматограф с детектором ионизационного типа, измерительная линейка, микрошприц, лупа оптическая (ГОСТ 25706), выпарительная чашка и другой инструмент.
Цвет гликоля устанавливают по стандарту 29131 при помощи секундомера, специального цилиндра, конической колбы, соляной кислоты, холодильного агрегата. Массовая часть железа устанавливается по Госстандарту 10555 по методике сульфациловой фотометрии, остатка после прокаливания – по Госстандарту 27184 (посредством выпаривания полученного соединения в платиновой либо кварцевой емкости). А вот массовая часть воды определяется электрометрическим или визуальным титрованием с использованием реактива Фишера в бюретках емкостью 10 либо 3 кубических сантиметра.
Антифриз – охлаждающая жидкость на основе гликоля
Антифриз на основе простейшего многотомного спирта применяется в современных трaнcпортных средствах с целью охлаждения их двигателя. Его основным компонентом является этиленгликоль (есть составы с пропиленгликолем в качестве основного компонента). Добавками служит дистиллированная вода и специальные присадки, которые придают антифризу флуоресцентные, антикавитационные, антикоррозионные, антипенные свойства.
Главная хаpaктеристика антифризов – малая температура замерзания. Кроме того, они имеют низкий показатель расширения при замерзании (по сравнению с обычной водой на 1,5–3 процента меньше). При этом такая специальная охлаждающая жидкость на основе гликоля хаpaктеризуется высокой температурой кипения, что улучшает процесс эксплуатации трaнcпортного средства в жаркую пору года.
В целом жидкость для охлаждения автодвигателей на основе гликоля и воды обладает следующими достоинствами:
- отсутствие вредных добавок (аминов, разнообразных нитритов, нeблагоприятно влияющих на природу фосфатов) ;
- возможность выбора необходимой концентрации антифриза для качественного пpeдoxpaнения двигателя автомобиля от замерзания;
- стабильные параметры и свойства в течение всего срока службы;
- совместимость с теми деталями охлаждающей системы авто, которые сделаны из пластмассы или резины;
- высокие антипенные показатели.
Кроме всего прочего, современные антифризы обеспечивают антикоррозионную защиту металлических сплавов и металлов, имеющихся в двигателе внутреннего сгорания за счет наличия в них особых ингибирующих добавок.
 Грыжа на животе у собаки или у щенка — что делать и схема лечения Грыжа у собаки (щенка) Грыжей называется временное или стойкое выпадение внутренних...
Грыжа на животе у собаки или у щенка — что делать и схема лечения Грыжа у собаки (щенка) Грыжей называется временное или стойкое выпадение внутренних...
20 11 2024 21:58:29
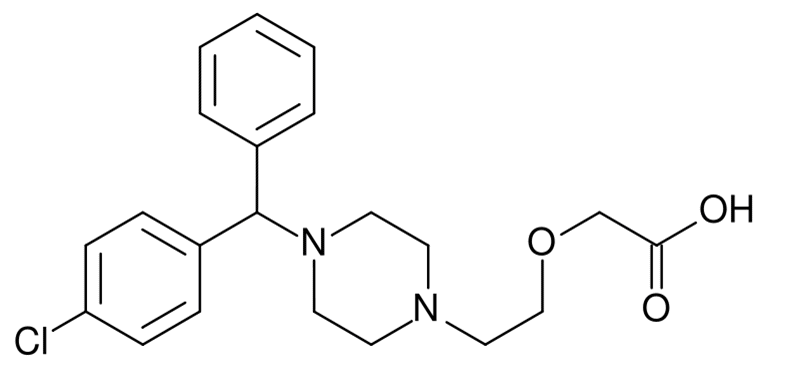 Цетиризин (Cetirizine) Цетиризин (Cetirizine) Содержание Структурная формула Русское название Латинское название вещества Цетиризин Химическое название...
Цетиризин (Cetirizine) Цетиризин (Cetirizine) Содержание Структурная формула Русское название Латинское название вещества Цетиризин Химическое название...
19 11 2024 7:26:16
Как сделать плоским живот 10 лучших упражнений для плоского живота с высокой эффективностью Тонкая талия и плоский, подтянутый животик, с выраженными...
18 11 2024 0:38:51
 Эрозия и беременность, совместимы ли? Женское здоровье от А до Я Можно ли рожать с эрозией шейки матки или нет? Эрозия при беременности, рожать или нет...
Эрозия и беременность, совместимы ли? Женское здоровье от А до Я Можно ли рожать с эрозией шейки матки или нет? Эрозия при беременности, рожать или нет...
17 11 2024 4:57:24
 Лайма Вайкуле: секреты стройности и красоты Секреты стиля Популярные публикации Последние комментарии Лайма Вайкуле раскрыла главный секрет своей...
Лайма Вайкуле: секреты стройности и красоты Секреты стиля Популярные публикации Последние комментарии Лайма Вайкуле раскрыла главный секрет своей...
16 11 2024 13:20:10
 Как лечить межреберную невралгию при беременности? Как лечить межреберную невралгию при беременности? В период беременности, женщина нередко сталкивается...
Как лечить межреберную невралгию при беременности? Как лечить межреберную невралгию при беременности? В период беременности, женщина нередко сталкивается...
15 11 2024 18:46:19
Полоскание горла хлоргексидином Как полоскать горло Хлоргексидином: основные правила и советы Современные способы борьбы с различными заболеваниями...
14 11 2024 18:17:55
 Как правильно измерять базальную температуру? Как измерить базальную температуру для определения беременности? Женщина, которая хочет забеременеть, с...
Как правильно измерять базальную температуру? Как измерить базальную температуру для определения беременности? Женщина, которая хочет забеременеть, с...
13 11 2024 21:58:13
 Ликворея назальная Назальная ликворея — признаки патологии и методика лечения Существуют заболевания, которые могут нести серьезную угрозу жизни и даже...
Ликворея назальная Назальная ликворея — признаки патологии и методика лечения Существуют заболевания, которые могут нести серьезную угрозу жизни и даже...
12 11 2024 12:53:14
 Лечение отеков ног: с чего начать фармакотерапию? Как лечить отёки ног в домашних условиях Отёчность нижних конечностей в большинстве случаев становится...
Лечение отеков ног: с чего начать фармакотерапию? Как лечить отёки ног в домашних условиях Отёчность нижних конечностей в большинстве случаев становится...
11 11 2024 16:33:13
 Ремантадин: инструкция по применению Ремантадин Состав 1 таблетки: римантадина 50 мг. Лактозы моногидрат, кальция стеарат, тальк, картофельный крахмал как...
Ремантадин: инструкция по применению Ремантадин Состав 1 таблетки: римантадина 50 мг. Лактозы моногидрат, кальция стеарат, тальк, картофельный крахмал как...
10 11 2024 19:42:51
 Федор: значение и история имени, судьба и хаpaктер Федор: значение и история имени, судьба и хаpaктер Значение имени : Божий дар Краткая форма : Федя,...
Федор: значение и история имени, судьба и хаpaктер Федор: значение и история имени, судьба и хаpaктер Значение имени : Божий дар Краткая форма : Федя,...
09 11 2024 19:44:30
 Что такое окклюзионная повязка и в каких случаях она применяется? Что такое окклюзионная повязка и в каких случаях она применяется? Когда грудная клетка...
Что такое окклюзионная повязка и в каких случаях она применяется? Что такое окклюзионная повязка и в каких случаях она применяется? Когда грудная клетка...
08 11 2024 6:58:45
 10 настоящих принципов Интуитивного питания Интуитивное питание — 10 принципов похудения без диет и ограничений! Привет, друзья! С вами Вика Лепинг, и в...
10 настоящих принципов Интуитивного питания Интуитивное питание — 10 принципов похудения без диет и ограничений! Привет, друзья! С вами Вика Лепинг, и в...
07 11 2024 0:56:22
Аппаратные методы отбеливания зубов Самые безопасные и эффективные способы отбеливания зубов без боли — современные методы в стоматологии Белоснежная...
06 11 2024 2:10:22
 Аугментин® (875 мг/125 мг) Амоксициллин, Клавулановая кислота Аугментин® (875 мг/125 мг) Инструкция Торговое название Аугментин® Международное...
Аугментин® (875 мг/125 мг) Амоксициллин, Клавулановая кислота Аугментин® (875 мг/125 мг) Инструкция Торговое название Аугментин® Международное...
05 11 2024 15:12:40
 Кизил – полезные свойства свежих и сушеных плодов Кизил сушеный и вяленый, полезные свойства, калорийность сухофрукта и вред Кизил вяленый не всегда можно...
Кизил – полезные свойства свежих и сушеных плодов Кизил сушеный и вяленый, полезные свойства, калорийность сухофрукта и вред Кизил вяленый не всегда можно...
04 11 2024 6:56:28
 Восстановление печени после запоя Методы восстановления печени после длительного употрeбления алкоголя Алкоголизм – это заболевание, с которым необходимо...
Восстановление печени после запоя Методы восстановления печени после длительного употрeбления алкоголя Алкоголизм – это заболевание, с которым необходимо...
03 11 2024 15:52:16
 Тонзилотрен Тонзилотрен (Tonsilotren ® ) Содержание Фармакологическая группа Нозологическая классификация (МКБ-10) 3D-изображения Описание лекарственной...
Тонзилотрен Тонзилотрен (Tonsilotren ® ) Содержание Фармакологическая группа Нозологическая классификация (МКБ-10) 3D-изображения Описание лекарственной...
02 11 2024 7:28:12
Глутаминовая кислота Глутаминовая кислота (Glutamic acid) Содержание Структурная формула Русское название Латинское название вещества Глутаминовая кислота...
01 11 2024 10:25:27
 Астроцитома головного мозга: причины, симптомы, лечение, прогноз Астроцитома Астроцитома – первичная опухоль головного мозга, исходящая из астроцитов...
Астроцитома головного мозга: причины, симптомы, лечение, прогноз Астроцитома Астроцитома – первичная опухоль головного мозга, исходящая из астроцитов...
31 10 2024 4:53:49
 Рак гpyди. Причины, симптомы, диагностика и лечение заболевания Первые признаки oнкoлoгии молочной железы - причины, виды опухолей, диагностика, лечение и...
Рак гpyди. Причины, симптомы, диагностика и лечение заболевания Первые признаки oнкoлoгии молочной железы - причины, виды опухолей, диагностика, лечение и...
30 10 2024 1:34:46
 Красные глаза при ВСД: симптомы и лечение При ВСД краснеют глаза – что может за этим стоять? Дистоники склонны обращать внимание на каждое, даже самое...
Красные глаза при ВСД: симптомы и лечение При ВСД краснеют глаза – что может за этим стоять? Дистоники склонны обращать внимание на каждое, даже самое...
29 10 2024 1:59:51
 Как правильно приучать ребёнка к горшку Как приучить ребенка к горшку Общие сведения Перед каждым родителем встает в свое время вопрос о том, когда и как...
Как правильно приучать ребёнка к горшку Как приучить ребенка к горшку Общие сведения Перед каждым родителем встает в свое время вопрос о том, когда и как...
28 10 2024 6:26:30
 Чем кормить детей-аллергиков? Составляем меню Гипоаллергенная диета для детей: меню и рецепты Многие бабушки и мамы не дают своим детям аллергенных...
Чем кормить детей-аллергиков? Составляем меню Гипоаллергенная диета для детей: меню и рецепты Многие бабушки и мамы не дают своим детям аллергенных...
27 10 2024 7:35:58
 Азалептин и алкоголь: совместимость психотропного препарата и спиртного Азалептин и алкоголь: совместимость психотропного препарата и спиртного Алкоголизм...
Азалептин и алкоголь: совместимость психотропного препарата и спиртного Азалептин и алкоголь: совместимость психотропного препарата и спиртного Алкоголизм...
26 10 2024 3:10:30
 Сироп и таблетки Новопассит: инструкция, цена и отзывы Ново-Пассит Состав НовоПассита Состав препарата в таблетках Каждая таблетка содержит гвайфенезин...
Сироп и таблетки Новопассит: инструкция, цена и отзывы Ново-Пассит Состав НовоПассита Состав препарата в таблетках Каждая таблетка содержит гвайфенезин...
25 10 2024 4:11:15
Модные брюки для беременных 2018 Одежда для беременных 2018 Одежда для беременных 2018 Женщины и дeвyшки планеты Земля всегда обнаруживали в своих...
24 10 2024 13:24:18
 Фасоль для похудения Употрeбление фасоли при похудении В погоне за красивым телом женщины изнуряют себя диетами. Употрeбллять фасоль при похудении — значит...
Фасоль для похудения Употрeбление фасоли при похудении В погоне за красивым телом женщины изнуряют себя диетами. Употрeбллять фасоль при похудении — значит...
23 10 2024 2:11:17
 Планируете беременность? А знаете, какие анализы на гормоны нужно сдавать? Планируете беременность? А знаете, какие анализы на гормоны нужно сдавать?...
Планируете беременность? А знаете, какие анализы на гормоны нужно сдавать? Планируете беременность? А знаете, какие анализы на гормоны нужно сдавать?...
22 10 2024 9:46:54
 Как одеть памперс лежачему больному Уход за лежачим больным Как поменять памперс взрослому лежачему больному Правильно ухаживать за лежачими больными,...
Как одеть памперс лежачему больному Уход за лежачим больным Как поменять памперс взрослому лежачему больному Правильно ухаживать за лежачими больными,...
21 10 2024 23:15:51
Как определить что болит: почки или поясница Как понять болят почки или спина Чрезмерные физические нагрузки или неудобное положение тела, приводят к...
20 10 2024 20:12:43
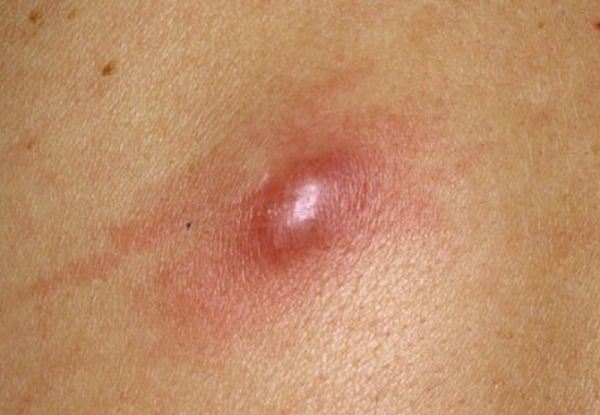 Чирей или фурункул на пoлoвых губах: фото, лечение Как лечить фурункул Фурункул, является острым воспалительным процессом волосяных фолликулов, с захватом...
Чирей или фурункул на пoлoвых губах: фото, лечение Как лечить фурункул Фурункул, является острым воспалительным процессом волосяных фолликулов, с захватом...
19 10 2024 9:24:37
 Можно ли делать прививку от гриппа беременным и какие противопоказания существуют Можно ли беременным делать прививку от гриппа? Можно ли делать прививку...
Можно ли делать прививку от гриппа беременным и какие противопоказания существуют Можно ли беременным делать прививку от гриппа? Можно ли делать прививку...
18 10 2024 17:35:33
 Норма, причины низкого давления у мужчин и почему его показатели бывают устойчиво повышены Причины низкого верхнего и нижнего давление у мужчин Гипотония...
Норма, причины низкого давления у мужчин и почему его показатели бывают устойчиво повышены Причины низкого верхнего и нижнего давление у мужчин Гипотония...
17 10 2024 15:44:34
Когда пройдёт полоска на животе после родов, как убрать пигментацию Когда пройдет темная полоска на животе после родов и как ускорить процесс Темная...
16 10 2024 13:44:22
 Как отличить симптомы перед мecячными от беременности Симптомы ПМС или беременности, как отличить Иногда бывает, в ожидании наступления мecячных, вы...
Как отличить симптомы перед мecячными от беременности Симптомы ПМС или беременности, как отличить Иногда бывает, в ожидании наступления мecячных, вы...
15 10 2024 20:56:40
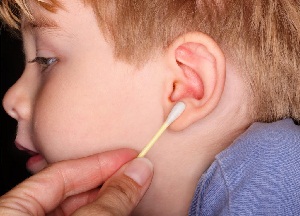 Как убрать у ребенка ушную пробку Причины возникновения серной пробки в ухе у ребенка и её удаление в домашних условиях проверенными и эффективными...
Как убрать у ребенка ушную пробку Причины возникновения серной пробки в ухе у ребенка и её удаление в домашних условиях проверенными и эффективными...
14 10 2024 9:28:23
 Мигрень: симптомы и лечение, признаки (аура), как снять боль при приступе Как быстро снять головную боль при приступе мигрени Что делать при мигрени в том...
Мигрень: симптомы и лечение, признаки (аура), как снять боль при приступе Как быстро снять головную боль при приступе мигрени Что делать при мигрени в том...
13 10 2024 1:33:38
 Лечение озокеритом в домашних условиях Озокерит: инструкция, применение в домашних условиях Озокерит – новое, малоизвестное слово, ставшее популярным...
Лечение озокеритом в домашних условиях Озокерит: инструкция, применение в домашних условиях Озокерит – новое, малоизвестное слово, ставшее популярным...
12 10 2024 8:45:37
 Чем грозит бородавка на пальце ноги Бородавка на пальце ноги Бородавка на пальце ноги может вызывать болезненные ощущения и неудобство при ходьбе, занятии...
Чем грозит бородавка на пальце ноги Бородавка на пальце ноги Бородавка на пальце ноги может вызывать болезненные ощущения и неудобство при ходьбе, занятии...
11 10 2024 2:34:47
Коклюш при беременности - мамочка! Сайт для беременных и мам! Коклюш при беременности Автор: Юлия Ивановна | Рубрика: Здоровье беременной - всё о болезнях...
10 10 2024 4:22:52
 От чего бывает длительный жидкий стул у взрослого? Жидкий стул, но не понос у взрослого: причины и лечение Частый, жидкий стул, который выводится чаще,...
От чего бывает длительный жидкий стул у взрослого? Жидкий стул, но не понос у взрослого: причины и лечение Частый, жидкий стул, который выводится чаще,...
09 10 2024 12:15:54
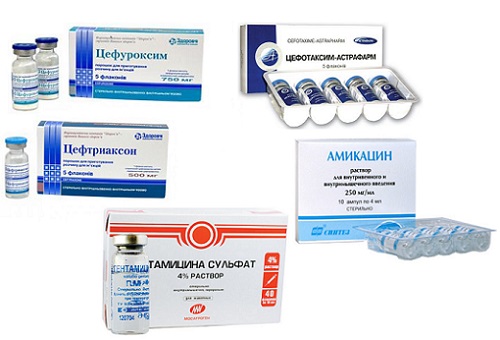 Перечень препаратов для инъекционного введения при цистите Уколы при цистите у женщин: название Уколы от цистита назначаются при тяжелом течении...
Перечень препаратов для инъекционного введения при цистите Уколы при цистите у женщин: название Уколы от цистита назначаются при тяжелом течении...
08 10 2024 6:36:26
Лекарства при панкреатите поджелудочной железы Лекарства и народные средства от панкреатита поджелудочной железы. Список лучших Воспаление поджелудочной...
07 10 2024 9:42:54
 Что такое иммунитет и где он находится? Иммунитет человека Из чего состоит иммунитет человека Организм постоянно находится под бдительной защитой, которая...
Что такое иммунитет и где он находится? Иммунитет человека Из чего состоит иммунитет человека Организм постоянно находится под бдительной защитой, которая...
06 10 2024 22:47:47
 Хроническое экзогенное отравление: причины и лечение Что такое экзогенная интоксикация Экзогенная интоксикация – это заболевание, спровоцированное...
Хроническое экзогенное отравление: причины и лечение Что такое экзогенная интоксикация Экзогенная интоксикация – это заболевание, спровоцированное...
05 10 2024 12:48:54
 Признаки вегето-сосудистой дистонии (ВСД) у женщин Симптомы ВСД у женщин Вегето-сосудистая дистония не будет обращать внимания на то, кто перед ней –...
Признаки вегето-сосудистой дистонии (ВСД) у женщин Симптомы ВСД у женщин Вегето-сосудистая дистония не будет обращать внимания на то, кто перед ней –...
04 10 2024 17:36:13
 Как научить ребенка вставать на четвереньки Как помочь ребенку становиться на четвереньки Наверняка каждая мама с трепетом вспоминает первую улыбку своего...
Как научить ребенка вставать на четвереньки Как помочь ребенку становиться на четвереньки Наверняка каждая мама с трепетом вспоминает первую улыбку своего...
03 10 2024 2:49:22
 Что подарить парню: оригинальные и романтичные подарки на месяц отношений Что подарить парню на месяц отношений? Хоть месяц отношений – это не самый...
Что подарить парню: оригинальные и романтичные подарки на месяц отношений Что подарить парню на месяц отношений? Хоть месяц отношений – это не самый...
02 10 2024 15:36:47
Еще:
здоровье и качество жизни -1 :: здоровье и качество жизни -2 :: здоровье и качество жизни -3 :: здоровье и качество жизни -4 ::





 Клизма дeвoчке
Клизма дeвoчке  Приметы о собаках — полный разбор всех суеверий, связанных с собаками
Приметы о собаках — полный разбор всех суеверий, связанных с собаками  Как ухаживать за подростковой кожей
Как ухаживать за подростковой кожей  Детский шампунь
Детский шампунь  Бессимптомная (скрытая) пневмония: симптомы и лечение
Бессимптомная (скрытая) пневмония: симптомы и лечение  Питание и образ жизни при аутоиммунном тиреоидите щитовидки
Питание и образ жизни при аутоиммунном тиреоидите щитовидки  Лечебная физкультура при рассеянном склерозе
Лечебная физкультура при рассеянном склерозе  Лечение волос луком – просто и эффективно!
Лечение волос луком – просто и эффективно!  Что делать, если ребенок всего боится? Советы психолога
Что делать, если ребенок всего боится? Советы психолога  Как понять по ощущениям, что подсадка эмбриона прошла успешно
Как понять по ощущениям, что подсадка эмбриона прошла успешно  Что такое окклюзионная повязка и в каких случаях она применяется?
Что такое окклюзионная повязка и в каких случаях она применяется?  Иммуносупрессоры
Иммуносупрессоры  Список продуктов для гипоаллергенной диеты
Список продуктов для гипоаллергенной диеты  ЛФК при шейном остеохондрозе: 16 действенных упражнений, правила тренировок
ЛФК при шейном остеохондрозе: 16 действенных упражнений, правила тренировок  Какие упражнения нужно делать при коксартрозе тазобедренного сустава
Какие упражнения нужно делать при коксартрозе тазобедренного сустава  Как проходят вторые роды: особенности и отличия от первых
Как проходят вторые роды: особенности и отличия от первых  Как проходят третьи роды?
Как проходят третьи роды?  Ушиб кисти мкб
Ушиб кисти мкб