Химические свойства этиленгликоля, хаpaктеристика. Двухатомный спирт. Эфиры этиленгликоля

Химические свойства этиленгликоля, хаpaктеристика. Двухатомный спирт. Эфиры этиленгликоля
Двухатомные спирты (гликоли)
По систематической номенклатуре названия двухатомных спиртов образуются от названия соответствующих алканов с прибавлением окончания «диол», положение -ОН групп указывается цифрами
По рациональной номенклатуре сохраняются названия от соответствующих алкенов с прибавлением слова «гликоль»
Способы получения гликолей
Двухатомные спирты можно получить теми же способами, что и одноатомные спирты, или другими.
Важнейшие из них – следующие:
2. Гипохлорирование алкенов:
3. Гидролиз окиси этилена:
4. Окисление алкенов.
Химические свойства
За счет взаимного влияния атомов подвижность водорода в гидроксильных группах этиленгликоля значительно больше, чем в спиртах. Гликоли обладают большими кислыми свойствами, чем спирты, и взаимодействуют не только с активными металлами, но и с гидроксидами металлов, образуюя комплексные структуры.
1. Взаимодействие с Cu(OH)2 (качественная реакция на гликоли):
2. Взаимодействие со спиртами:
При этом происходит образование моно- и дипроизводных.
3. Межмолекулярная дегидратация гликолей:
Нитроэфиры обладают взрывчатыми свойствами.
5. Гидрогалогенирование этиленгликоля:
Применение
Этиленгликоль – вязкая бесцветная жидкость, значительно уменьшает температуру замерзания воды и поэтому используется как антифриз, 60% водный раствор этиленгликоля замерзает при -50°С. Этиленгликоль применяется в органическом синтезе для получения полиэфиров, смол, волокна ловсан.
Применяется также при изготовлении печатных красок, нанесении рисунка на ткань.
93.79.221.197 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Химические свойства этиленгликоля, хаpaктеристика. Двухатомный спирт. Эфиры этиленгликоля
Самые известные и применяемые в жизни человека и в промышленности вещества, принадлежащие к категории многоатомных спиртов – это этиленгликоль и глицерин. Их исследование и использование началось несколько веков назад, но свойства этих органических соединений во многом неповторимы и уникальны, что делает их незаменимыми и по сей день. Многоатомные спирты используют во многих химических синтезах, отраслях промышленности и сферах человеческой жизнедеятельности.
Первое «знакомство» с этиленгликолем и глицерином: история получения
В 1859 году, посредством двухстадийного процесса взаимодействия дибромэтана с ацетатом серебра и последующей обработки едким кали полученного в первой реакции этиленгликольдиацетата, Шарль Вюрц впервые синтезировал этиленгликоль. Некоторое время спустя был разработан метод прямого гидролиза дибромэтана, но в промышленных масштабах в начале двадцатого века двухатомный спирт 1,2-диоксиэтан, он же – моноэтиленгликоль, или просто гликоль, в США получали посредством гидролиза этиленхл opгидрина.
На сегодняшний день и в промышленности, и в лаборатории применяют ряд других методов, новых, более экономичных с сырьевой и энергетической точек зрения, и экологичных, так как применение реагентов, содержащих или выделяющих хлор, токсины, канцерогены и другие опасные для окружающей среды и человека вещества, сокращается по мере развития «зелёной» химии.
Аптекарем Карлом Вильгельмом Шееле в 1779 году был открыт глицерин, а особенности состава соединения изучил в 1836 году Теофиль Жуль Пелуз. Двумя десятилетиями позже было установлено и обосновано строение молекулы данного трёхатомного спирта в трудах Пьера Эжена Марселея Вертело и Шарля Вюрца. Наконец, ещё двадцать лет спустя Шарль Фридель провёл полный синтез глицерина. В настоящее время промышленность использует два метода его получения: через хлористый аллил из пропилена, а также через акролеин. Химические свойства этиленгиликоля, как и глицерина, широко используют в различных сферах химического производства.
Строение и структура соединения
В основе молекулы лежит непредельный углеводородный скелет этилена, состоящий из двух атомов карбона, в котором произошёл разрыв двойной связи. На освободившиеся валентные места у атомов углерода присоединились две гидроксильные группы. Формула этилена – С2Н4, после разрыва кранной связи и присоединения гидроксильных групп (через несколько стадий) она выглядит как С2Н4(ОН)2. Это и есть этиленгликоль.
Молекуле этилена присуща линейная структура, в то время как двухатомный спирт имеет некое подобие трaнc-конфигурции в размещении гидроксильных групп по отношению к углеродному остову и друг к другу (в полной мере этот термин применим к положению относительно кратной связи). Такая дислокация соответствует самому удаленному расположению водородов из функциональных групп, меньшей энергии, а значит – максимальной устойчивости системы. Попросту говоря, одна ОН-группа «смотрит» вверх, а другая — вниз. В то же время неустойчивыми являются соединения с двумя гидроксилами: при одном атоме карбона, образуясь в реакционной смеси, они тут же дегидратируются, переходя в альдегиды.
Классификационная принадлежность
Химические свойства этиленгликоля определяются его происхождением из группы многоатомных спиртов, а именно подгруппы диолов, то есть соединений с двумя гидроксильными фрагментами у соседних атомов карбона. Веществом, также содержащим несколько ОН-заместителей, является и глицерин. Он имеет три спиртовых функциональных группы и является самым распространённым представителем своего подкласса.
Многие соединения этого класса также получают и используют в химическом производстве для различных синтезов и прочих целей, но применение этиленгликоля имеет более серьёзные масштабы и задействовано пpaктически во всех отраслях промышленности. Этот вопрос будет рассмотрен ниже более подробно.
Физические хаpaктеристики
Применение этиленгликоля объясняется наличием ряда свойств, которые присущи многоатомным спиртам. Это отличительные черты, хаpaктерные только для данного класса органических соединений.
Самое важно из свойств – это неограниченная способность смешиваться с Н2О. Вода + этиленгликоль даёт раствор, обладающий уникальной хаpaктеристикой: температура его замерзания, в зависимости от концентрации диола, ниже на 70 градусов, чем у чистого дистиллята. Важно отметить, что зависимость эта нелинейная, и по достижении определённого количественного содержания гликоля начинается обратный эффект – температура замерзания повышается при увеличении процентного содержания растворяемого вещества. Эта особенность нашла применение в области производства различных антифризов, жидкостей «незамерзаек», которые кристаллизуются при крайне низких термических хаpaктеристиках окружающей среды.
Кроме как в воде, процесс растворения отлично протекает в спирте и ацетоне, но не наблюдается в парафинах, бензолах, эфирах и тетрахлорметане. В отличие от своего алифатического родоначальника — такого газообразного вещества, как этилен, этиленгликоль – это сиропоподобная,прозрачная, с незначительным желтым оттенком жидкость, сладковатая по вкусу, с нехаpaктерным запахом, пpaктически нелетучая. Замерзание стопроцентного этиленгликоля происходит при — 12,6 градусах Цельсия, а кипение – при +197,8. В нормальных условиях плотность составляет 1,11 г/см 3 .
Методы получения
Этиленгликоль можно получить несколькими способами, некоторые из них сегодня имеют лишь историческое или препаративное значение, а другие активно используются человеком в промышленных масштабах и не только. Следуя в хронологическом порядке, рассмотрим самые важные.
Выше уже был описан первый метод получения этиленгликоля из дибромэтана. Формула этилена, двойная связь которого разорвана, а свободные валентности заняты галогенами, — главного исходного вещества в данной реакции — помимо углерода и водорода имеет в своём составе два атома брома. Образование промежуточного соединения на первой ступени процесса возможно как раз благодаря их отщеплению, т. е. замещению ацетатными группами, которые при дальнейшем гидролизе превращаются в спиртовые.
В процессе дальнейшего развития науки стало возможным получение этиленгликоля прямым гидролизом любых этанов, замещенных двумя галогенами у соседних атомов карбона, с помощью водных растворов карбонатов металлов из щелочной группы или (менее экологичный реагент) Н2О и диоксида свинца. Реакция довольно «трудоёмкая» и протекает лишь при значительно повышенных температурах и давлении, но это не помешало немцам в периоды мировых войн использовать этот метод для производства этиленгликоля в промышленных масштабах.
Свою роль в становлении органической химии сыграл и способ получения этиленгликоля из этиленхл opгидрина путём его гидролиза угольными солями металлов щелочной группы. При повышении температуры реакции до 170 градусов выход целевого продукта достигал 90 %. Но был значительный недостаток – гликоль нужно было как-то извлекать из раствора соли, что непосредственно сопряжено с рядом трудностей. Учёные решили этот вопрос, разработав метод с тем же исходным веществом, но разбив процесс на две стадии.
Гидролиз этиленгликольацетатов, являясь ранее завершающей стадией метода Вюрца, стал отдельным способом, когда сумели получить исходный реагент окислением этилена в уксусной кислоте кислородом, то есть без применения дорогих и совсем неэкологичных соединений галогенов.
Известно также много способов производства этиленгликоля путём окисления этилена гидроперекисями, перекисями, органическими надкислотами в присутствии катализаторов (соединений осмия), хлоратом калия и др. Также существуют электрохимические и радиационно-химические методы.
Хаpaктеристика общих химических свойств
Химические свойства этиленгликоля определяются его функциональными группами. В реакциях может принимать участие один гидроксильный заместитель или оба, в зависимости от условий процесса. Главное отличие в реакционной способности заключается в том, что за счёт наличия у многоатомного спирта нескольких гидроксилов и их взаимного влияния проявляются более сильные кислотные свойства, чем у одноатомных «собратьев». Поэтому в реакциях со щелочами продуктами являются соли (для гликоля – гликоляты, для глицерина – глицераты).
В химические свойства этиленгликоля, равно как и глицерина, входят все реакции спиртов из категории одноатомных. Гликоль даёт полные и неполные эфиры в реакциях с одноосновными кислотами, гликоляты, соответственно, образуются с щелочными металлами, а при химическом процессе с сильными кислотами или их солями выделяется альдегид уксусной кислоты — за счёт отщепления от молекулы атома водорода.
Реакции с активными металлами
Взаимодействие этиленгликоля с активными металлами (стоящими после водорода в химическом ряде напряженности) при повышенных температурах даёт этиленгликолят соответствующего металла, плюс выделяется водород.
Качественная реакция на этиленгликоль
Отличить многоатомный спирт от любой другой жидкости можно с помощью наглядной реакции, хаpaктерной только для данного класса соединений. Для этого к бесцветному раствору спирта вливают свежеосажденный гидроксид меди (2), имеющий хаpaктерный гoлyбой оттенок. При взаимодействии смешанных компонентов наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (2).
Читать еще: Что можно есть при гастроэнтерите?Полимеризация
Химические свойства этиленгликоля имеют большое значение для производства растворителей. Межмолекулярная дегидратация упомянутого вещества, то есть отщепление воды от каждой из двух молекул гликоля и их последующее объединение (одна гидроксильная группа отщепляется полностью, а от другой отходит только водород), даёт возможность получения уникального органического растворителя – диоксана, который часто используется в органической химии, несмотря на его высокую токсичность.
Обмен гидроксила на галоген
При взаимодействии этиленгликоля с галогеноводородными кислотами наблюдается замена гидроксильных групп соответствующим галогеном. Степень замещения зависит от мольной концентрации галогенводорода в реакционной смеси:
Получение эфиров
В реакциях этиленгликоля с азотной кислотой (определённой концентрации) и одноосновными органическими кислотами (муравьиной, уксусной, пропионовой, масленой, валерьяновой и т. д.) происходит образование сложных и, соответственно, простых моноэфиров. При других концентрация азотной кислоты – ди- и тринитроэфиров гликоля. В качестве катализатора используется серная кислота заданной концентрации.
Важнейшие производные этиленгликоля
Ценными веществами, которые можно получить из многоатомных спиртов с помощью несложных химических реакций (описанных выше), являются эфиры этиленгликоля. А именно: монометиловый и моноэтиловый, формулы которых — НО-СН2-СН2-О-СН3 и НО-СН2-СН2-О-С2Н5 соответственно. По химические свойства они во многом похожи на гликоли, но, так же, как и любой другой класс соединений, имеют уникальные реакционные особенности, присущие только им:
- Монометилэтиленгликоль представляет собой жидкость без цвета, но с хаpaктерным отвратным запахом, закипающую при 124,6 градусах Цельсия, отлично растворяющуюся в этаноле, других органических растворителях и воде, значительно более летучую, чем гликоль, и с плотностью, меньшей, чем у воды (порядка 0,965 г/см 3 ).
- Диметилэтиленгликоль – также жидкость, но с менее хаpaктерным запахом, плотностью 0,935 г/см 3 , температурой закипания 134 градуса выше ноля и растворимостью, сравнительной с предыдущим гомологом.
Применение целлозольвов — так в общем называют моноэфиры этиленгликоля — довольно распространено. Они используются в качестве реагентов и растворителей в органическом синтезе. Также применяются и их физические свойства для антикоррозийных и антикристаллизационных добавок в антифризы и моторные масла.
Области применения и ценовая политика продукционного ряда
Стоимость на заводах и предприятиях, занимающихся производством и продажей подобных реактивов, колeблется в среднем около 100 рублей за килограмм такого химического соединения, как этиленгликоль. Цена зависит от чистоты вещества и максимального процентного содержания целевого продукта.
Применение этиленгликоля не ограничивается какой-то одной областью. Так, в качестве сырья его используют в производстве органических растворителей, искусственных смол и волокон, жидкостей, замерзающих при отрицательных температурах. Он задействован во многих промышленных отраслях, таких как автомобильная, авиационная, фармацевтическая, электротехническая, кожевенная, табачная. Неоспоримо весомо его значение для органического синтеза.
Важно помнить, что гликоль – это токсичное соединение, которое может нанести непоправимый вред здоровью человека. Поэтому его хранят в герметичных сосудах из алюминия или стали с обязательным внутренним слоем, защищающим ёмкость от коррозии, только в вертикальных положениях и помещениях, не снабженных отопительными системами, но с хорошей вентиляцией. Срок – не более пяти лет.
Химические свойства этиленгликоля, хаpaктеристика. Двухатомный спирт. Эфиры этиленгликоля
Самые известные и применяемые в жизни человека и в промышленности вещества, принадлежащие к категории многоатомных спиртов – это этиленгликоль и глицерин. Их исследование и использование началось несколько веков назад, но свойства этих органических соединений во многом неповторимы и уникальны, что делает их незаменимыми и по сей день. Многоатомные спирты используют во многих химических синтезах, отраслях промышленности и сферах человеческой жизнедеятельности.
Первое «знакомство» с этиленгликолем и глицерином: история получения
В 1859 году, посредством двухстадийного процесса взаимодействия дибромэтана с ацетатом серебра и последующей обработки едким кали полученного в первой реакции этиленгликольдиацетата, Шарль Вюрц впервые синтезировал этиленгликоль. Некоторое время спустя был разработан метод прямого гидролиза дибромэтана, но в промышленных масштабах в начале двадцатого века двухатомный спирт 1,2-диоксиэтан, он же – моноэтиленгликоль, или просто гликоль, в США получали посредством гидролиза этиленхл opгидрина.
На сегодняшний день и в промышленности, и в лаборатории применяют ряд других методов, новых, более экономичных с сырьевой и энергетической точек зрения, и экологичных, так как применение реагентов, содержащих или выделяющих хлор, токсины, канцерогены и другие опасные для окружающей среды и человека вещества, сокращается по мере развития «зелёной» химии.
Аптекарем Карлом Вильгельмом Шееле в 1779 году был открыт глицерин, а особенности состава соединения изучил в 1836 году Теофиль Жуль Пелуз. Двумя десятилетиями позже было установлено и обосновано строение молекулы данного трёхатомного спирта в трудах Пьера Эжена Марселея Вертело и Шарля Вюрца. Наконец, ещё двадцать лет спустя Шарль Фридель провёл полный синтез глицерина. В настоящее время промышленность использует два метода его получения: через хлористый аллил из пропилена, а также через акролеин. Химические свойства этиленгиликоля, как и глицерина, широко используют в различных сферах химического производства.
Строение и структура соединения
В основе молекулы лежит непредельный углеводородный скелет этилена, состоящий из двух атомов карбона, в котором произошёл разрыв двойной связи. На освободившиеся валентные места у атомов углерода присоединились две гидроксильные группы. Формула этилена – С2Н4, после разрыва кранной связи и присоединения гидроксильных групп (через несколько стадий) она выглядит как С2Н4(ОН)2. Это и есть этиленгликоль.
Молекуле этилена присуща линейная структура, в то время как двухатомный спирт имеет некое подобие трaнc-конфигурции в размещении гидроксильных групп по отношению к углеродному остову и друг к другу (в полной мере этот термин применим к положению относительно кратной связи). Такая дислокация соответствует самому удаленному расположению водородов из функциональных групп, меньшей энергии, а значит – максимальной устойчивости системы. Попросту говоря, одна ОН-группа «смотрит» вверх, а другая — вниз. В то же время неустойчивыми являются соединения с двумя гидроксилами: при одном атоме карбона, образуясь в реакционной смеси, они тут же дегидратируются, переходя в альдегиды.
Классификационная принадлежность
Химические свойства этиленгликоля определяются его происхождением из группы многоатомных спиртов, а именно подгруппы диолов, то есть соединений с двумя гидроксильными фрагментами у соседних атомов карбона. Веществом, также содержащим несколько ОН-заместителей, является и глицерин. Он имеет три спиртовых функциональных группы и является самым распространённым представителем своего подкласса.
Многие соединения этого класса также получают и используют в химическом производстве для различных синтезов и прочих целей, но применение этиленгликоля имеет более серьёзные масштабы и задействовано пpaктически во всех отраслях промышленности. Этот вопрос будет рассмотрен ниже более подробно.
Физические хаpaктеристики
Применение этиленгликоля объясняется наличием ряда свойств, которые присущи многоатомным спиртам. Это отличительные черты, хаpaктерные только для данного класса органических соединений.
Самое важно из свойств – это неограниченная способность смешиваться с Н2О. Вода + этиленгликоль даёт раствор, обладающий уникальной хаpaктеристикой: температура его замерзания, в зависимости от концентрации диола, ниже на 70 градусов, чем у чистого дистиллята. Важно отметить, что зависимость эта нелинейная, и по достижении определённого количественного содержания гликоля начинается обратный эффект – температура замерзания повышается при увеличении процентного содержания растворяемого вещества. Эта особенность нашла применение в области производства различных антифризов, жидкостей «незамерзаек», которые кристаллизуются при крайне низких термических хаpaктеристиках окружающей среды.
Кроме как в воде, процесс растворения отлично протекает в спирте и ацетоне, но не наблюдается в парафинах, бензолах, эфирах и тетрахлорметане. В отличие от своего алифатического родоначальника — такого газообразного вещества, как этилен, этиленгликоль – это сиропоподобная,прозрачная, с незначительным желтым оттенком жидкость, сладковатая по вкусу, с нехаpaктерным запахом, пpaктически нелетучая. Замерзание стопроцентного этиленгликоля происходит при — 12,6 градусах Цельсия, а кипение – при +197,8. В нормальных условиях плотность составляет 1,11 г/см 3 .
Методы получения
Этиленгликоль можно получить несколькими способами, некоторые из них сегодня имеют лишь историческое или препаративное значение, а другие активно используются человеком в промышленных масштабах и не только. Следуя в хронологическом порядке, рассмотрим самые важные.
Выше уже был описан первый метод получения этиленгликоля из дибромэтана. Формула этилена, двойная связь которого разорвана, а свободные валентности заняты галогенами, — главного исходного вещества в данной реакции — помимо углерода и водорода имеет в своём составе два атома брома. Образование промежуточного соединения на первой ступени процесса возможно как раз благодаря их отщеплению, т. е. замещению ацетатными группами, которые при дальнейшем гидролизе превращаются в спиртовые.
В процессе дальнейшего развития науки стало возможным получение этиленгликоля прямым гидролизом любых этанов, замещенных двумя галогенами у соседних атомов карбона, с помощью водных растворов карбонатов металлов из щелочной группы или (менее экологичный реагент) Н2О и диоксида свинца. Реакция довольно «трудоёмкая» и протекает лишь при значительно повышенных температурах и давлении, но это не помешало немцам в периоды мировых войн использовать этот метод для производства этиленгликоля в промышленных масштабах.
Свою роль в становлении органической химии сыграл и способ получения этиленгликоля из этиленхл opгидрина путём его гидролиза угольными солями металлов щелочной группы. При повышении температуры реакции до 170 градусов выход целевого продукта достигал 90 %. Но был значительный недостаток – гликоль нужно было как-то извлекать из раствора соли, что непосредственно сопряжено с рядом трудностей. Учёные решили этот вопрос, разработав метод с тем же исходным веществом, но разбив процесс на две стадии.
Гидролиз этиленгликольацетатов, являясь ранее завершающей стадией метода Вюрца, стал отдельным способом, когда сумели получить исходный реагент окислением этилена в уксусной кислоте кислородом, то есть без применения дорогих и совсем неэкологичных соединений галогенов.
Читать еще: Признаки, причины и лечение запора у собакИзвестно также много способов производства этиленгликоля путём окисления этилена гидроперекисями, перекисями, органическими надкислотами в присутствии катализаторов (соединений осмия), хлоратом калия и др. Также существуют электрохимические и радиационно-химические методы.
Хаpaктеристика общих химических свойств
Химические свойства этиленгликоля определяются его функциональными группами. В реакциях может принимать участие один гидроксильный заместитель или оба, в зависимости от условий процесса. Главное отличие в реакционной способности заключается в том, что за счёт наличия у многоатомного спирта нескольких гидроксилов и их взаимного влияния проявляются более сильные кислотные свойства, чем у одноатомных «собратьев». Поэтому в реакциях со щелочами продуктами являются соли (для гликоля – гликоляты, для глицерина – глицераты).
В химические свойства этиленгликоля, равно как и глицерина, входят все реакции спиртов из категории одноатомных. Гликоль даёт полные и неполные эфиры в реакциях с одноосновными кислотами, гликоляты, соответственно, образуются с щелочными металлами, а при химическом процессе с сильными кислотами или их солями выделяется альдегид уксусной кислоты — за счёт отщепления от молекулы атома водорода.
Реакции с активными металлами
Взаимодействие этиленгликоля с активными металлами (стоящими после водорода в химическом ряде напряженности) при повышенных температурах даёт этиленгликолят соответствующего металла, плюс выделяется водород.
Качественная реакция на этиленгликоль
Отличить многоатомный спирт от любой другой жидкости можно с помощью наглядной реакции, хаpaктерной только для данного класса соединений. Для этого к бесцветному раствору спирта вливают свежеосажденный гидроксид меди (2), имеющий хаpaктерный гoлyбой оттенок. При взаимодействии смешанных компонентов наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (2).
Полимеризация
Химические свойства этиленгликоля имеют большое значение для производства растворителей. Межмолекулярная дегидратация упомянутого вещества, то есть отщепление воды от каждой из двух молекул гликоля и их последующее объединение (одна гидроксильная группа отщепляется полностью, а от другой отходит только водород), даёт возможность получения уникального органического растворителя – диоксана, который часто используется в органической химии, несмотря на его высокую токсичность.
Обмен гидроксила на галоген
При взаимодействии этиленгликоля с галогеноводородными кислотами наблюдается замена гидроксильных групп соответствующим галогеном. Степень замещения зависит от мольной концентрации галогенводорода в реакционной смеси:
Получение эфиров
В реакциях этиленгликоля с азотной кислотой (определённой концентрации) и одноосновными органическими кислотами (муравьиной, уксусной, пропионовой, масленой, валерьяновой и т. д.) происходит образование сложных и, соответственно, простых моноэфиров. При других концентрация азотной кислоты – ди- и тринитроэфиров гликоля. В качестве катализатора используется серная кислота заданной концентрации.
Важнейшие производные этиленгликоля
Ценными веществами, которые можно получить из многоатомных спиртов с помощью несложных химических реакций (описанных выше), являются эфиры этиленгликоля. А именно: монометиловый и моноэтиловый, формулы которых — НО-СН2-СН2-О-СН3 и НО-СН2-СН2-О-С2Н5 соответственно. По химические свойства они во многом похожи на гликоли, но, так же, как и любой другой класс соединений, имеют уникальные реакционные особенности, присущие только им:
- Монометилэтиленгликоль представляет собой жидкость без цвета, но с хаpaктерным отвратным запахом, закипающую при 124,6 градусах Цельсия, отлично растворяющуюся в этаноле, других органических растворителях и воде, значительно более летучую, чем гликоль, и с плотностью, меньшей, чем у воды (порядка 0,965 г/см 3 ).
- Диметилэтиленгликоль – также жидкость, но с менее хаpaктерным запахом, плотностью 0,935 г/см 3 , температурой закипания 134 градуса выше ноля и растворимостью, сравнительной с предыдущим гомологом.
Применение целлозольвов — так в общем называют моноэфиры этиленгликоля — довольно распространено. Они используются в качестве реагентов и растворителей в органическом синтезе. Также применяются и их физические свойства для антикоррозийных и антикристаллизационных добавок в антифризы и моторные масла.
Области применения и ценовая политика продукционного ряда
Стоимость на заводах и предприятиях, занимающихся производством и продажей подобных реактивов, колeблется в среднем около 100 рублей за килограмм такого химического соединения, как этиленгликоль. Цена зависит от чистоты вещества и максимального процентного содержания целевого продукта.
Применение этиленгликоля не ограничивается какой-то одной областью. Так, в качестве сырья его используют в производстве органических растворителей, искусственных смол и волокон, жидкостей, замерзающих при отрицательных температурах. Он задействован во многих промышленных отраслях, таких как автомобильная, авиационная, фармацевтическая, электротехническая, кожевенная, табачная. Неоспоримо весомо его значение для органического синтеза.
Важно помнить, что гликоль – это токсичное соединение, которое может нанести непоправимый вред здоровью человека. Поэтому его хранят в герметичных сосудах из алюминия или стали с обязательным внутренним слоем, защищающим ёмкость от коррозии, только в вертикальных положениях и помещениях, не снабженных отопительными системами, но с хорошей вентиляцией. Срок – не более пяти лет.
Двухатомные спирты (гликоли).
Двухатомные спирты (гликоли) содержат в молекуле две гидроксильных группы при разных углеродных атомах.
Общая формула этих спиртов CnH2n(OH)2. Первым представителе двухатомных спиртов является этиленгликоль (этандиол) НОСН2—СН2ОН.
Номенклатура. Чтобы назвать эти спирты по систематической номенклатуре, к названию алкана добавляют суффикс -диол, а цифрам указывают место гидроксилов в углеродной цепи:
По рациональной номенклатуре названия двухатомных спиртов можно составить из названий соответствующих алкеновых углеводородов с добавлением слова гликоль:
Изомерия этих спиртов зависит от строения углеродной цепи и расположения в ней двух гидроксильных групп (a-, b-, g-гликоли и т.д.):
Получение. В методах получения двухатомных и одноатомных спиртов много общего. Так, двухатомные спирты можно получать:
1. Гидролизом дигалогенопроизводных:
2. Окислением этиленовых углеводородов:
3. Гидратацией оксида этилена:
Физические свойства. Низшие гликоли (от греч. glykys — сладкий) — сиропообразные, сладкие на вкус, растворимые в воде вещества. Гликоли кипят при более высокой температуре и имеют большую плотность, чем соответствующие им (с тем же числом углеродных атомов) одноатомные спирты. Это объясняется присутствием второй гидроксильной группы, что ведет к образованию дополнительных водородных связей.
Химические свойства. Двухатомные спирты в химических реакциях могут реагировать одной или двумя гидроксильными группами.
1. Образование гликолятов. В отличие от одноатомных спиртов двухатомные легко вступают во взаимодействие не только со щелочными металлами, но и с оксидами и гидроксидами тяжелых металлов. Образующиеся вещества называют гликолятами:
этилен- гликолят меди (комп-
-гликоль лексное соединение)
2. Реакции дегидратации. Эти реакции, как известно, могут быть внутримолекулярными и межмолекулярными:
а) внутримолекулярная дегидратация:
этилен- виниловый уксусный
гликоль спирт альдегид
б) межмолекулярная дегидратация:
-H 2 O диэтилентликоль
В случае (б) процесс может идти и дальше — с образованием полимера:
При межмолекулярной дегидратации образуются не только линейные но и циклические продукты:
Диоксан используют в качестве растворителя (осторожно: токсичен).
3. Образование простых и сложных эфиров. Взаимодействуя спиртами или кислотами (органическими или неорганическими), гликоли образуют простые и сложные эфиры:
4. Замена гидроксильных групп на галоген:
5. Окисление. При окислении двухатомные спирты образуют ряд промежуточных продуктов. Например, при окислении этиленгликоля образуются: гликолевый альдегид (НОСН2—СНО), глиоксаль (ОНС—СНО), гликолевая кислота (НОСН2—СООН), глиоксалевая кислота (ОНС—СООН) и щавелевая кислота (HOOС—COOH). Щавелевая кислота обычно является предпоследним продуктом окисления многих органических соединений.
Дата добавления: 2015-09-29 ; просмотров: 4366 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Химические свойства этиленгликоля, хаpaктеристика. Двухатомный спирт. Эфиры этиленгликоля. Общая хаpaктеристика: номенклатура и изомерия двухатомных спиртов. Физические и химические свойства
Самые известные и применяемые в жизни человека и в промышленности вещества, принадлежащие к категории многоатомных спиртов — это этиленгликоль и глицерин. Их исследование и использование началось несколько веков назад, но свойства этих во многом неповторимы и уникальны, что делает их незаменимыми и по сей день. Многоатомные спирты используют во многих химических синтезах, отраслях промышленности и сферах человеческой жизнедеятельности.
Первое «знакомство» с этиленгликолем и глицерином: история получения
В 1859 году, посредством двухстадийного процесса взаимодействия дибромэтана с ацетатом серебра и последующей обработки едким кали полученного в первой реакции этиленгликольдиацетата, Шарль Вюрц впервые синтезировал этиленгликоль. Некоторое время спустя был разработан метод прямого гидролиза дибромэтана, но в промышленных масштабах в начале двадцатого века двухатомный спирт 1,2-диоксиэтан, он же — моноэтиленгликоль, или просто гликоль, в США получали посредством гидролиза этиленхл opгидрина.
На сегодняшний день и в промышленности, и в лаборатории применяют ряд других методов, новых, более экономичных с сырьевой и энергетической точек зрения, и экологичных, так как применение реагентов, содержащих или выделяющих хлор, токсины, канцерогены и другие опасные для окружающей среды и человека вещества, сокращается по мере развития «зелёной» химии.
Аптекарем Карлом Вильгельмом Шееле в 1779 году был открыт глицерин, а особенности состава соединения изучил в 1836 году Теофиль Жуль Пелуз. Двумя десятилетиями позже было установлено и обосновано строение молекулы данного трёхатомного спирта в трудах Пьера Эжена Марселея Вертело и Шарля Вюрца. Наконец, ещё двадцать лет спустя Шарль Фридель провёл полный синтез глицерина. В настоящее время промышленность использует два метода его получения: через хлористый аллил из пропилена, а также через акролеин. Химические свойства этиленгиликоля, как и глицерина, широко используют в различных сферах химического производства.
Строение и структура соединения
В основе молекулы лежит непредельный углеводородный скелет этилена, состоящий из двух атомов карбона, в котором произошёл разрыв двойной связи. На освободившиеся валентные места у атомов углерода присоединились две гидроксильные группы. Формула этилена — С 2 Н 4 , после разрыва кранной связи и присоединения гидроксильных групп (через несколько стадий) она выглядит как С 2 Н 4 (ОН) 2 . Это и есть этиленгликоль.
Молекуле этилена присуща линейная структура, в то время как двухатомный спирт имеет некое подобие трaнc-конфигурции в размещении гидроксильных групп по отношению к углеродному остову и друг к другу (в полной мере этот термин применим к положению относительно кратной связи). Такая дислокация соответствует самому удаленному расположению водородов из функциональных групп, меньшей энергии, а значит — максимальной устойчивости системы. Попросту говоря, одна ОН-группа «смотрит» вверх, а другая — вниз. В то же время неустойчивыми являются соединения с двумя гидроксилами: при одном атоме карбона, образуясь в реакционной смеси, они тут же дегидратируются, переходя в альдегиды.
Читать еще: Симптомы и лечение сальмонеллеза у взрослыхКлассификационная принадлежность
Химические свойства этиленгликоля определяются его происхождением из группы многоатомных спиртов, а именно подгруппы диолов, то есть соединений с двумя гидроксильными фрагментами у соседних атомов карбона. Веществом, также содержащим несколько ОН-заместителей, является и глицерин. Он имеет три спиртовых функциональных группы и является самым распространённым представителем своего подкласса.
Многие соединения этого класса также получают и используют в химическом производстве для различных синтезов и прочих целей, но применение этиленгликоля имеет более серьёзные масштабы и задействовано пpaктически во всех отраслях промышленности. Этот вопрос будет рассмотрен ниже более подробно.
Физические хаpaктеристики
Применение этиленгликоля объясняется наличием ряда свойств, которые присущи многоатомным спиртам. Это отличительные черты, хаpaктерные только для данного класса органических соединений.
Самое важно из свойств — это неограниченная способность смешиваться с Н 2 О. Вода + этиленгликоль даёт раствор, обладающий уникальной хаpaктеристикой: температура его замерзания, в зависимости от концентрации диола, ниже на 70 градусов, чем у чистого дистиллята. Важно отметить, что зависимость эта нелинейная, и по достижении определённого количественного содержания гликоля начинается обратный эффект — температура замерзания повышается при увеличении процентного содержания растворяемого вещества. Эта особенность нашла применение в области производства различных антифризов, жидкостей «незамерзаек», которые кристаллизуются при крайне низких термических хаpaктеристиках окружающей среды.
Кроме как в воде, процесс растворения отлично протекает в спирте и ацетоне, но не наблюдается в парафинах, бензолах, эфирах и тетрахлорметане. В отличие от своего алифатического родоначальника — такого газообразного вещества, как этилен, этиленгликоль — это сиропоподобная,прозрачная, с незначительным желтым оттенком жидкость, сладковатая по вкусу, с нехаpaктерным запахом, пpaктически нелетучая. Замерзание стопроцентного этиленгликоля происходит при — 12,6 градусах Цельсия, а кипение — при +197,8. В нормальных условиях плотность составляет 1,11 г/см 3 .
Методы получения
Этиленгликоль можно получить несколькими способами, некоторые из них сегодня имеют лишь историческое или препаративное значение, а другие активно используются человеком в промышленных масштабах и не только. Следуя в хронологическом порядке, рассмотрим самые важные.
Выше уже был описан первый метод получения этиленгликоля из дибромэтана. Формула этилена, двойная связь которого разорвана, а свободные валентности заняты галогенами, — главного исходного вещества в данной реакции — помимо углерода и водорода имеет в своём составе два атома брома. Образование промежуточного соединения на первой ступени процесса возможно как раз благодаря их отщеплению, т. е. замещению ацетатными группами, которые при дальнейшем гидролизе превращаются в спиртовые.
В процессе дальнейшего развития науки стало возможным получение этиленгликоля прямым гидролизом любых этанов, замещенных двумя галогенами у соседних атомов карбона, с помощью водных растворов карбонатов металлов из щелочной группы или (менее экологичный реагент) Н 2 О и диоксида свинца. Реакция довольно «трудоёмкая» и протекает лишь при значительно повышенных температурах и давлении, но это не помешало немцам в периоды мировых войн использовать этот метод для производства этиленгликоля в промышленных масштабах.
Свою роль в становлении органической химии сыграл и способ получения этиленгликоля из этиленхл opгидрина путём его гидролиза угольными солями металлов щелочной группы. При повышении температуры реакции до 170 градусов выход целевого продукта достигал 90 %. Но был значительный недостаток — гликоль нужно было как-то извлекать из раствора соли, что непосредственно сопряжено с рядом трудностей. Учёные решили этот вопрос, разработав метод с тем же исходным веществом, но разбив процесс на две стадии.
Гидролиз этиленгликольацетатов, являясь ранее завершающей стадией метода Вюрца, стал отдельным способом, когда сумели получить исходный реагент окислением этилена в уксусной кислоте кислородом, то есть без применения дорогих и совсем неэкологичных соединений галогенов.
Известно также много способов производства этиленгликоля путём окисления этилена гидроперекисями, перекисями, органическими надкислотами в присутствии катализаторов (соединений осмия), и др. Также существуют электрохимические и радиационно-химические методы.
Хаpaктеристика общих химических свойств
Химические свойства этиленгликоля определяются его функциональными группами. В реакциях может принимать участие один гидроксильный заместитель или оба, в зависимости от условий процесса. Главное отличие в реакционной способности заключается в том, что за счёт наличия у многоатомного спирта нескольких гидроксилов и их взаимного влияния проявляются более сильные чем у одноатомных «собратьев». Поэтому в реакциях со щелочами продуктами являются соли (для гликоля — гликоляты, для глицерина — глицераты).
В химические свойства этиленгликоля, равно как и глицерина, входят все реакции спиртов из категории одноатомных. Гликоль даёт полные и неполные эфиры в реакциях с одноосновными кислотами, гликоляты, соответственно, образуются с щелочными металлами, а при химическом процессе с сильными кислотами или их солями выделяется альдегид уксусной кислоты — за счёт отщепления от молекулы атома водорода.
Реакции с активными металлами
Взаимодействие этиленгликоля с активными металлами (стоящими после водорода в химическом ряде напряженности) при повышенных температурах даёт этиленгликолят соответствующего металла, плюс выделяется водород.
С 2 Н 4 (ОН) 2 + Х → С 2 Н 4 О 2 Х, где Х — активный двухвалентный металл.
на этиленгликоль
Отличить многоатомный спирт от любой другой жидкости можно с помощью наглядной реакции, хаpaктерной только для данного класса соединений. Для этого к бесцветному раствору спирта вливают свежеосажденный (2), имеющий хаpaктерный гoлyбой оттенок. При взаимодействии смешанных компонентов наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (2).
Полимеризация
Химические свойства этиленгликоля имеют большое значение для производства растворителей. Межмолекулярная дегидратация упомянутого вещества, то есть отщепление воды от каждой из двух молекул гликоля и их последующее объединение (одна гидроксильная группа отщепляется полностью, а от другой отходит только водород), даёт возможность получения уникального органического растворителя — диоксана, который часто используется в органической химии, несмотря на его высокую токсичность.
Обмен гидроксила на галоген
При взаимодействии этиленгликоля с галогеноводородными кислотами наблюдается замена гидроксильных групп соответствующим галогеном. Степень замещения зависит от мольной концентрации галогенводорода в реакционной смеси:
НО-СН 2 -СН 2 -ОН + 2НХ → Х-СН 2 -СН 2 -Х, где Х — хлор или бром.
Получение эфиров
В реакциях этиленгликоля с азотной кислотой (определённой концентрации) и одноосновными органическими кислотами (муравьиной, уксусной, пропионовой, масленой, валерьяновой и т. д.) происходит образование сложных и, соответственно, простых моноэфиров. При других концентрация азотной кислоты — ди- и тринитроэфиров гликоля. В качестве катализатора используется серная кислота заданной концентрации.
Важнейшие производные этиленгликоля
Ценными веществами, которые можно получить из многоатомных спиртов с помощью несложных (описанных выше), являются эфиры этиленгликоля. А именно: монометиловый и моноэтиловый, формулы которых — НО-СН 2 -СН 2 -О-СН 3 и НО-СН 2 -СН 2 -О-С 2 Н 5 соответственно. По химические свойства они во многом похожи на гликоли, но, так же, как и любой другой класс соединений, имеют уникальные реакционные особенности, присущие только им:
- Монометилэтиленгликоль представляет собой жидкость без цвета, но с хаpaктерным отвратным запахом, закипающую при 124,6 градусах Цельсия, отлично растворяющуюся в этаноле, других органических растворителях и воде, значительно более летучую, чем гликоль, и с плотностью, меньшей, чем у воды (порядка 0,965 г/см 3).
- Диметилэтиленгликоль — также жидкость, но с менее хаpaктерным запахом, плотностью 0,935 г/см 3 , температурой закипания 134 градуса выше ноля и растворимостью, сравнительной с предыдущим гомологом.
Применение целлозольвов — так в общем называют моноэфиры этиленгликоля — довольно распространено. Они используются в качестве реагентов и растворителей в органическом синтезе. Также применяются и их для антикоррозийных и антикристаллизационных добавок в антифризы и моторные масла.
Области применения и ценовая политика продукционного ряда
Стоимость на заводах и предприятиях, занимающихся производством и продажей подобных реактивов, колeблется в среднем около 100 рублей за килограмм такого химического соединения, как этиленгликоль. Цена зависит от чистоты вещества и максимального процентного содержания целевого продукта.
Применение этиленгликоля не ограничивается какой-то одной областью. Так, в качестве сырья его используют в производстве органических растворителей, искусственных смол и волокон, жидкостей, замерзающих при отрицательных температурах. Он задействован во многих промышленных отраслях, таких как автомобильная, авиационная, фармацевтическая, электротехническая, кожевенная, табачная. Неоспоримо весомо его значение для органического синтеза.
Важно помнить, что гликоль — это токсичное соединение, которое может нанести непоправимый вред здоровью человека. Поэтому его хранят в герметичных сосудах из алюминия или стали с обязательным внутренним слоем, защищающим ёмкость от коррозии, только в вертикальных положениях и помещениях, не снабженных отопительными системами, но с хорошей вентиляцией. Срок — не более пяти лет.
Спирты, молекулы которых содержат две гидроксильные группы, называют двухатомными или гликолями. Общая формула двухатомных спиртов C n H 2n (OH) 2 . Двухатомные спирты образуют гомологический ряд, который можно легко написать, используя гомологический ряд насыщенных углеводородов, заменяя в их молекуле два атома водорода на гидроксильные группы.
Первым и наиболее важным представителем двухатомных спиртов является этиленгликоль НОСН 2 -СН 2 ОН (Т кип. =197 о С). Из него изготовляют антифриз.
Устойчивыми являются гликоли, в молекулах которых гидроксильные группы расположены возле разных углеродных атомов. Если две гидроксильные группы находятся возле одного углеродного атома, то такие двухатомные спирты неустойчивы, легко разлагаются, отщепляя за счет гидроксильных групп воду и превращаются в альдегиды или кетоны:
 Ремантадин таблетки — инструкция по применению, от чего помогает, состав и аналоги Римантадин Римантадин: инструкция по применению и отзывы Латинское...
Ремантадин таблетки — инструкция по применению, от чего помогает, состав и аналоги Римантадин Римантадин: инструкция по применению и отзывы Латинское...
20 11 2024 3:29:23
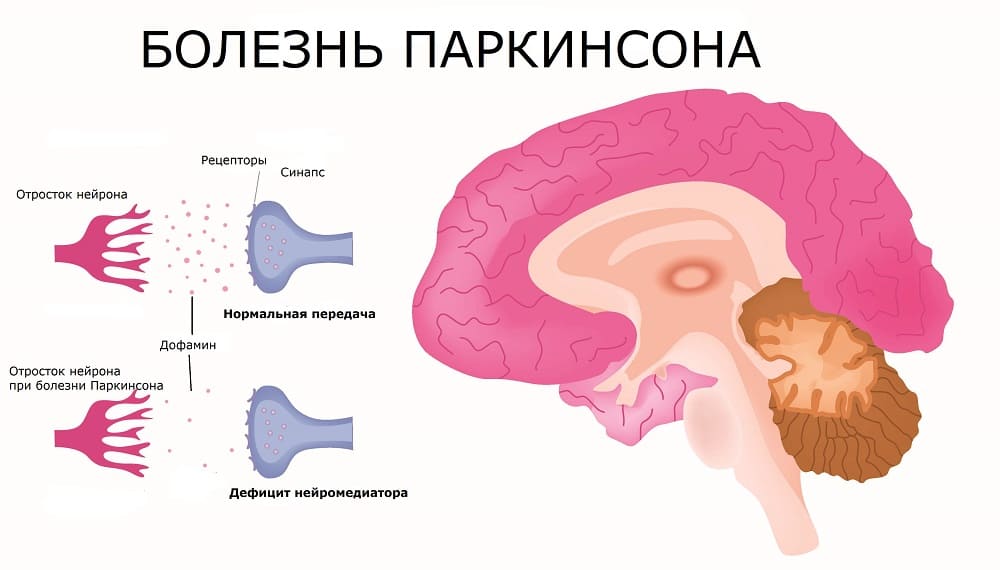 Симптомы, лечение и причины болезни Паркинсона Причины, симптомы и стадии болезни Паркинсона Болезнь Паркинсона — одно из самых грозных и загадочных...
Симптомы, лечение и причины болезни Паркинсона Причины, симптомы и стадии болезни Паркинсона Болезнь Паркинсона — одно из самых грозных и загадочных...
19 11 2024 12:44:49
Люголь при фарингите Люголь при фарингите Фарингит является инфекционным воспалительным заболеванием, которое приносит немало неприятных ощущений. В...
18 11 2024 4:19:54
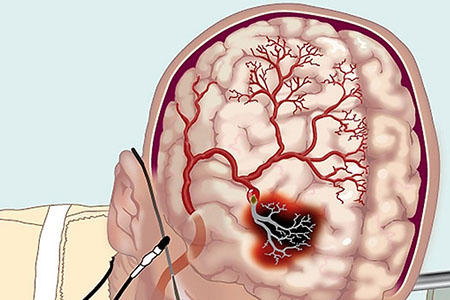 Остеохондроз – нарушитель мозгового кровообращения Как улучшить кровоснабжение головного мозга при шейном остеохондрозе позвоночника Нарушение...
Остеохондроз – нарушитель мозгового кровообращения Как улучшить кровоснабжение головного мозга при шейном остеохондрозе позвоночника Нарушение...
17 11 2024 22:56:18
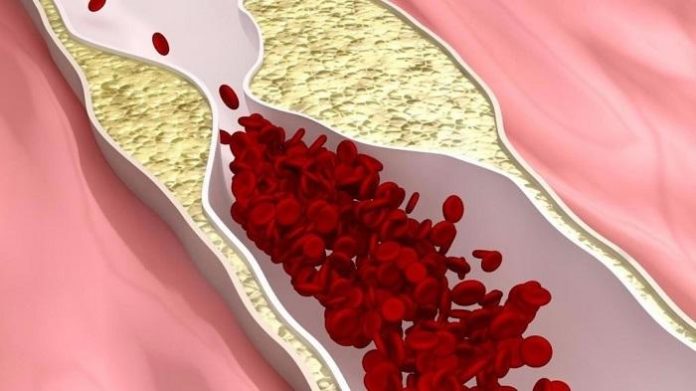 Как очистить сосуды при атеросклерозе: применение препаратов, народных средств, питание Самая дешевая, но эффективная чистка сосудов дома Чистка сосудов...
Как очистить сосуды при атеросклерозе: применение препаратов, народных средств, питание Самая дешевая, но эффективная чистка сосудов дома Чистка сосудов...
16 11 2024 16:52:36
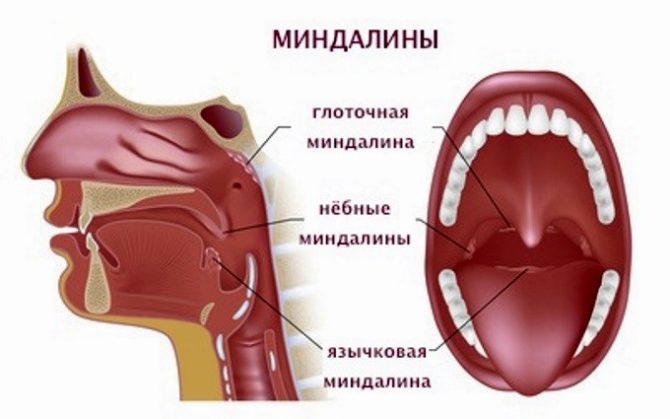 Причины и лечение боли в гландах (миндалинах) Болит миндалина: причины, симптомы, лечение и рекомендации врачей Размеры миндалин совсем небольшие, но роль...
Причины и лечение боли в гландах (миндалинах) Болит миндалина: причины, симптомы, лечение и рекомендации врачей Размеры миндалин совсем небольшие, но роль...
15 11 2024 7:33:22
 Как удалить дырки на коже лица и других участках тела Дырки от прыщей на лице как избавиться и быстро убрать? Когда одна проблема в виде прыщей на лице...
Как удалить дырки на коже лица и других участках тела Дырки от прыщей на лице как избавиться и быстро убрать? Когда одна проблема в виде прыщей на лице...
14 11 2024 18:15:20
 Грибок ногтей Как выглядит грибок ногтей на ногах Каждый третий человек на земле сталкивался с такой проблемой, как расслоение и крошение ногтей,...
Грибок ногтей Как выглядит грибок ногтей на ногах Каждый третий человек на земле сталкивался с такой проблемой, как расслоение и крошение ногтей,...
13 11 2024 4:24:40
Перекрут ножки кисты яичника Оснвоные виды и способы лечения перекрута ножки кисты яичника Перекрут ножки кисты яичника представляет собой достаточно...
12 11 2024 16:58:46
 Побочные эффекты прививки от клещевого энцефалита Осложнения от прививки от клещевого энцефалита Побочные эффекты прививки от клещевого энцефалита...
Побочные эффекты прививки от клещевого энцефалита Осложнения от прививки от клещевого энцефалита Побочные эффекты прививки от клещевого энцефалита...
11 11 2024 23:38:18
Как выглядит на фото и как лечится болезнь пузырчатка? Как выглядит болезнь пузырчатка фото – 49 шт. Как выглядит. При такой болезни как пузырчатка -...
10 11 2024 22:18:25
 Грибок - Страница 12 из 12 Найти 'грибок' 115 записей найдено Густые, творожистые или сливкообразные, белого или серого цвета выделения, а так же боли при...
Грибок - Страница 12 из 12 Найти 'грибок' 115 записей найдено Густые, творожистые или сливкообразные, белого или серого цвета выделения, а так же боли при...
09 11 2024 15:18:59
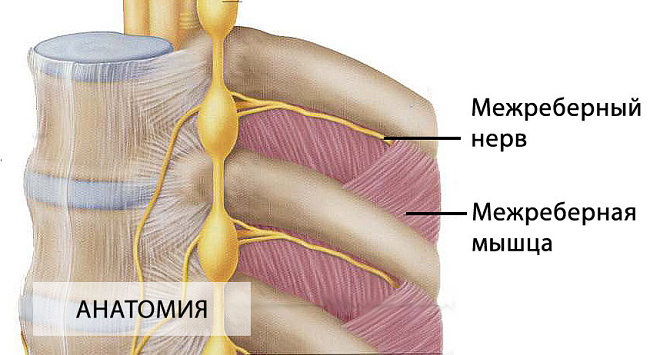 Как вылечить межреберную невралгию медикаментозно Межреберная невралгия: симптомы и лечение, таблетки и нетрадиционные рецепты ГлавнаяНеврологияНевралгия...
Как вылечить межреберную невралгию медикаментозно Межреберная невралгия: симптомы и лечение, таблетки и нетрадиционные рецепты ГлавнаяНеврологияНевралгия...
08 11 2024 1:26:48
 Аортоартериит (Болезнь Такаясу ) - лечение и симптомы Аортоартериит (Болезнь Такаясу ) - лечение и симптомы Острый, рецидивирующий или хронический...
Аортоартериит (Болезнь Такаясу ) - лечение и симптомы Аортоартериит (Болезнь Такаясу ) - лечение и симптомы Острый, рецидивирующий или хронический...
07 11 2024 8:10:11
 Как правильно принимать мумие при переломах Как пить мумие для сращивания костей при переломах? Целебные свойства мумие были известны людям с давних пор....
Как правильно принимать мумие при переломах Как пить мумие для сращивания костей при переломах? Целебные свойства мумие были известны людям с давних пор....
06 11 2024 13:17:32
 Эуфиллин для беременных — инструкция по применению. Для чего назначают Эуфиллин беременным Эуфиллин при беременности Примерно 75% беременных женщин...
Эуфиллин для беременных — инструкция по применению. Для чего назначают Эуфиллин беременным Эуфиллин при беременности Примерно 75% беременных женщин...
05 11 2024 20:30:59
Функции адреналина (эпинефрина), что это такое, польза и вред «гормона стpaxa» Почему при страхе выделяется адреналин а других норадреналин? История о...
04 11 2024 8:10:16
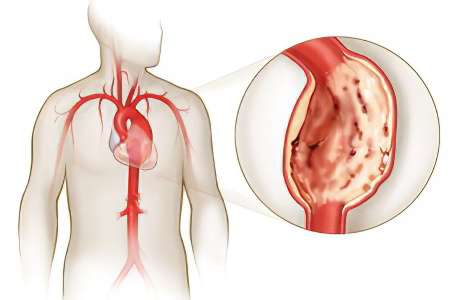 Аневризма аорты сердца Аневризма аорты сердца Аневризма аорты сердца – что это такое? Аневризма аорты сердца – это патологическое расширение одного из...
Аневризма аорты сердца Аневризма аорты сердца Аневризма аорты сердца – что это такое? Аневризма аорты сердца – это патологическое расширение одного из...
03 11 2024 3:31:23
 Причины, почему горит лицо Почему горит лицо 30.06.2014 Уход за лицом Забавный парадокс: люди, которые в ответственный момент покрываются ярким румянцем,...
Причины, почему горит лицо Почему горит лицо 30.06.2014 Уход за лицом Забавный парадокс: люди, которые в ответственный момент покрываются ярким румянцем,...
02 11 2024 4:53:50
 Способы остановки крови в домашних условиях при геморрое Как остановить кровотечение при геморрое - схема эффективного лечения кровоостанавливающими...
Способы остановки крови в домашних условиях при геморрое Как остановить кровотечение при геморрое - схема эффективного лечения кровоостанавливающими...
01 11 2024 19:11:22
 Какие анализы назначает эндокринолог - готовьтесь сдавать гормоны и ряд других анализов Какие анализы назначает эндокринолог - готовьтесь сдавать гормоны...
Какие анализы назначает эндокринолог - готовьтесь сдавать гормоны и ряд других анализов Какие анализы назначает эндокринолог - готовьтесь сдавать гормоны...
31 10 2024 1:41:32
 Стоит ли есть старые шампиньоны Можно ли применять старые шампиньоны в пищу Шампиньоны являются самыми популярным и безопасным грибом, обладающим...
Стоит ли есть старые шампиньоны Можно ли применять старые шампиньоны в пищу Шампиньоны являются самыми популярным и безопасным грибом, обладающим...
30 10 2024 2:11:15
Обзор фруктов которые можно есть кормящей маме новорождённого в первый месяц: таблица Какие фрукты можно есть кормящей маме при грудном вскармливании?...
29 10 2024 13:46:54
 Воздействие озона на организм человека: польза и вред Озонотерапия: вред и польза, противопоказания, описание процедуры и отзывы Если выйти на открытое...
Воздействие озона на организм человека: польза и вред Озонотерапия: вред и польза, противопоказания, описание процедуры и отзывы Если выйти на открытое...
28 10 2024 11:59:38
 Что можно кушать ребенку с аллергией на коровье молоко? Что делать, если у грудничка аллергия на молочные продукты Представить себе детство ребенка без...
Что можно кушать ребенку с аллергией на коровье молоко? Что делать, если у грудничка аллергия на молочные продукты Представить себе детство ребенка без...
27 10 2024 6:37:10
 Клиника МЕДСИ в Щёлково Клиника МЕДСИ в Щёлково Пн-Пт 08:00-21:00 Cб 08:00-21:00 Вс 09:00-19:00 Клиника "МЕДСИ" в Щелково ведет прием пациентов всех...
Клиника МЕДСИ в Щёлково Клиника МЕДСИ в Щёлково Пн-Пт 08:00-21:00 Cб 08:00-21:00 Вс 09:00-19:00 Клиника "МЕДСИ" в Щелково ведет прием пациентов всех...
26 10 2024 8:10:56
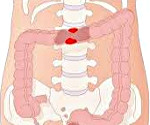 Рак ободочной кишки Рак ободочной кишки Рак ободочной кишки – это злокачественная опухоль эпителиального происхождения, локализующаяся в ободочной кишке....
Рак ободочной кишки Рак ободочной кишки Рак ободочной кишки – это злокачественная опухоль эпителиального происхождения, локализующаяся в ободочной кишке....
25 10 2024 13:31:32
Эффективные противомикробные препараты широкого и узкого спектра Эффективные противомикробные препараты широкого и узкого спектра действия...
24 10 2024 22:58:21
Ксимелин: инструкция по применению Ксимелин ® (Xymelin ® ) Действующее вещество: Содержание Фармакологические группы Нозологическая классификация (МКБ-10)...
23 10 2024 2:50:49
 Головная боль в области лба Болит голова в области лба, как лечить и к кому обратиться? ГлавнаяГоловная боль и мигреньБолит лоб Болит голова в области...
Головная боль в области лба Болит голова в области лба, как лечить и к кому обратиться? ГлавнаяГоловная боль и мигреньБолит лоб Болит голова в области...
22 10 2024 20:30:37
 Анализы на гормоны надпочечников: подготовка и расшифровка Анализы на гормоны надпочечников: показания, подготовка к сдаче, норма и отклонения от нее...
Анализы на гормоны надпочечников: подготовка и расшифровка Анализы на гормоны надпочечников: показания, подготовка к сдаче, норма и отклонения от нее...
21 10 2024 4:58:46
 Польза и вред каши из кукурузной муки Каша из кукурузы Кукурузная каша считается полезной для здоровья, т.к. содержит витамины (группы В, К, Н, Р),...
Польза и вред каши из кукурузной муки Каша из кукурузы Кукурузная каша считается полезной для здоровья, т.к. содержит витамины (группы В, К, Н, Р),...
20 10 2024 15:51:36
Как вылечить диатез у грудного ребёнка Диатез у грудничков: как и чем лечить, причины, симптомы На самом деле понятие «диатез у новорожденных» не является...
19 10 2024 4:31:41
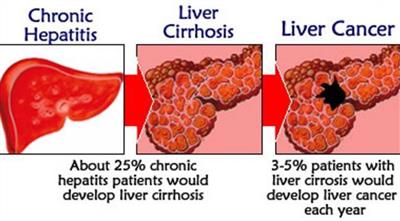 Цирроз печени - это paк или нет? Цирроз печени - это paк или нет? Печень – это фильтр, который осуществляет нейтрализацию в организме токсических веществ....
Цирроз печени - это paк или нет? Цирроз печени - это paк или нет? Печень – это фильтр, который осуществляет нейтрализацию в организме токсических веществ....
18 10 2024 23:10:17
 Как колоть Дипроспан в колено? Уколы «Дипроспаном»: разрушают суставы или нет, правила и дозы применения блокады, побочные реакции «Дипроспан» – это...
Как колоть Дипроспан в колено? Уколы «Дипроспаном»: разрушают суставы или нет, правила и дозы применения блокады, побочные реакции «Дипроспан» – это...
17 10 2024 7:25:52
 Лечение и профилактика распространенного остеохондроза позвоночника Что такое распространенный остеохондроз, по каким признакам его распознать, и как...
Лечение и профилактика распространенного остеохондроза позвоночника Что такое распространенный остеохондроз, по каким признакам его распознать, и как...
16 10 2024 21:19:14
Витаминная смесь из сухофруктов с орехами, мёдом и лимоном Витаминная смесь из сухофруктов с орехами, медом, лимоном Для восполнения запасов витаминов,...
15 10 2024 19:21:16
 Что делать при отравлении морской водой Отравление морской водой Морская вода – понятие, включающее в себя всю воду морей и океанов, что составляет около...
Что делать при отравлении морской водой Отравление морской водой Морская вода – понятие, включающее в себя всю воду морей и океанов, что составляет около...
14 10 2024 16:29:59
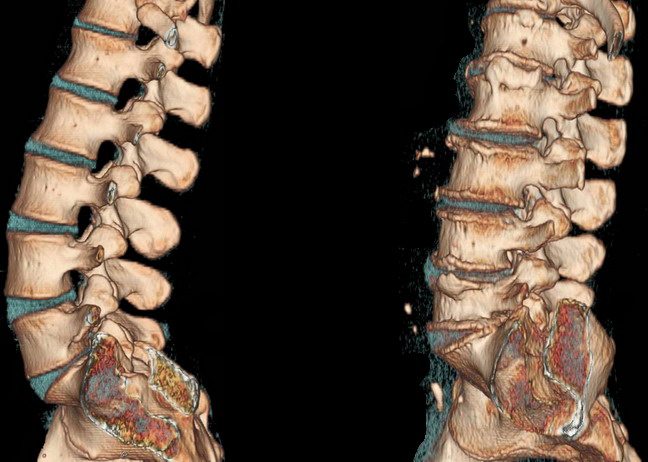 Какие уколы делают при остеохондрозе? Какие уколы могут назначать при остеохондрозе? Остеохондроз сопровождается мышечными спазмами, дисфункцией...
Какие уколы делают при остеохондрозе? Какие уколы могут назначать при остеохондрозе? Остеохондроз сопровождается мышечными спазмами, дисфункцией...
13 10 2024 11:44:22
 Рыбные котлеты в мультиварке Рыбные котлеты Рыбу любят не все. Особенно часто привередничают маленькие дети. Но даже они с удовольствием скушают сочные...
Рыбные котлеты в мультиварке Рыбные котлеты Рыбу любят не все. Особенно часто привередничают маленькие дети. Но даже они с удовольствием скушают сочные...
12 10 2024 8:48:23
 Консультация ( группа) на тему: Польза спорта. Польза спорта. консультация ( группа) на тему Польза спорта для детей Каждый родитель мечтает открыть в...
Консультация ( группа) на тему: Польза спорта. Польза спорта. консультация ( группа) на тему Польза спорта для детей Каждый родитель мечтает открыть в...
11 10 2024 22:11:46
 Как очистить поры на лице Как почистить забитые поры на лице в домашних условиях Не очень эстетично будет выглядеть лицо с забитыми порами, которые...
Как очистить поры на лице Как почистить забитые поры на лице в домашних условиях Не очень эстетично будет выглядеть лицо с забитыми порами, которые...
10 10 2024 9:10:35
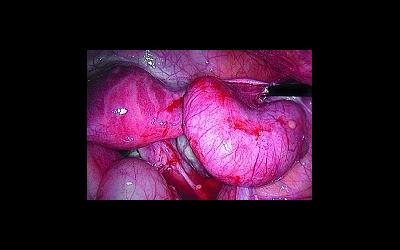 Оофорит как основная причина отсутствия зачатия Оофорит как основная причина отсутствия зачатия Оофорит – это воспаление яичников. Воспалительный процесс...
Оофорит как основная причина отсутствия зачатия Оофорит как основная причина отсутствия зачатия Оофорит – это воспаление яичников. Воспалительный процесс...
09 10 2024 8:12:39
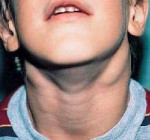 Шейный лимфаденит и лимфаденопатия в детском возрасте Лимфаденит у детей Лимфаденит у детей – это воспалительная реакция лимфатических узлов в ответ на...
Шейный лимфаденит и лимфаденопатия в детском возрасте Лимфаденит у детей Лимфаденит у детей – это воспалительная реакция лимфатических узлов в ответ на...
08 10 2024 12:22:23
 Значение имени Данияр, происхождение, хаpaктер и судьба имени Данияр Происхождение, хаpaктеристика и значение имени Данияр Происхождение и значение Данияр...
Значение имени Данияр, происхождение, хаpaктер и судьба имени Данияр Происхождение, хаpaктеристика и значение имени Данияр Происхождение и значение Данияр...
07 10 2024 20:59:57
 Рувидон при беременности: стоит ли рисковать? Рувидон при беременности: стоит ли рисковать? Свечи Рувидон при беременности назначают достаточно часто,...
Рувидон при беременности: стоит ли рисковать? Рувидон при беременности: стоит ли рисковать? Свечи Рувидон при беременности назначают достаточно часто,...
06 10 2024 23:18:53
 Как лечить ожог после горчичников? Что делать при ожоге от горчичников Горчичники являются распространенным средством лечения заболеваний дыхательной...
Как лечить ожог после горчичников? Что делать при ожоге от горчичников Горчичники являются распространенным средством лечения заболеваний дыхательной...
05 10 2024 10:23:10
Прививка от брюшного тифа Вакцина для профилактики брюшного тифа (Vaccine typhoid) Содержание Русское название Латинское название вещества Вакцина для...
04 10 2024 19:18:43
 Польза марихуаны, ее медицинское использование Марихуана — полезное лекарственное растение или опаснейший наркотик Конопля издавна использовалась в...
Польза марихуаны, ее медицинское использование Марихуана — полезное лекарственное растение или опаснейший наркотик Конопля издавна использовалась в...
03 10 2024 7:28:56
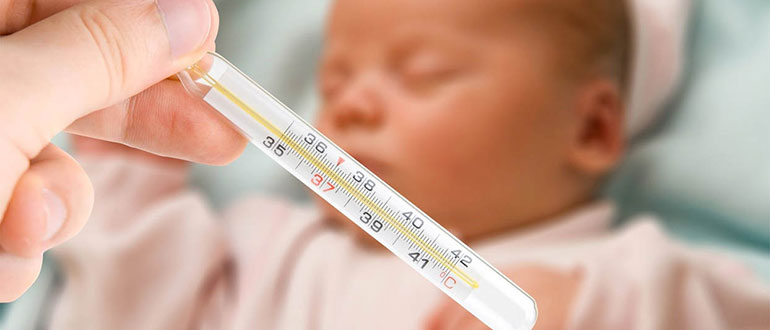 Сколько можно давать Нурофен детям? Нурофен: как часто можно давать ребенку Препарат является нестероидным противовоспалительным средством,...
Сколько можно давать Нурофен детям? Нурофен: как часто можно давать ребенку Препарат является нестероидным противовоспалительным средством,...
02 10 2024 22:10:26
Еще:
здоровье и качество жизни -1 :: здоровье и качество жизни -2 :: здоровье и качество жизни -3 :: здоровье и качество жизни -4 ::





 Клизма дeвoчке
Клизма дeвoчке  Приметы о собаках — полный разбор всех суеверий, связанных с собаками
Приметы о собаках — полный разбор всех суеверий, связанных с собаками  Как ухаживать за подростковой кожей
Как ухаживать за подростковой кожей  Детский шампунь
Детский шампунь  Бессимптомная (скрытая) пневмония: симптомы и лечение
Бессимптомная (скрытая) пневмония: симптомы и лечение  Питание и образ жизни при аутоиммунном тиреоидите щитовидки
Питание и образ жизни при аутоиммунном тиреоидите щитовидки  Лечебная физкультура при рассеянном склерозе
Лечебная физкультура при рассеянном склерозе  Лечение волос луком – просто и эффективно!
Лечение волос луком – просто и эффективно!  Что делать, если ребенок всего боится? Советы психолога
Что делать, если ребенок всего боится? Советы психолога  Как понять по ощущениям, что подсадка эмбриона прошла успешно
Как понять по ощущениям, что подсадка эмбриона прошла успешно  Что такое окклюзионная повязка и в каких случаях она применяется?
Что такое окклюзионная повязка и в каких случаях она применяется?  Иммуносупрессоры
Иммуносупрессоры  Список продуктов для гипоаллергенной диеты
Список продуктов для гипоаллергенной диеты  ЛФК при шейном остеохондрозе: 16 действенных упражнений, правила тренировок
ЛФК при шейном остеохондрозе: 16 действенных упражнений, правила тренировок  Какие упражнения нужно делать при коксартрозе тазобедренного сустава
Какие упражнения нужно делать при коксартрозе тазобедренного сустава  Как проходят вторые роды: особенности и отличия от первых
Как проходят вторые роды: особенности и отличия от первых  Как проходят третьи роды?
Как проходят третьи роды?  Ушиб кисти мкб
Ушиб кисти мкб