Какие группы аминокислот входят в состав белков?

Какие группы аминокислот входят в состав белков?
Какие группы аминокислот входят в состав белков?
Спортсмены и многие другие люди помнят курс биологии, в котором говорилось о важности белка в организме. Об аминокислотах упоминалось меньше, но они являются основой всех белковых соединений. В состав природных белков входит много различных аминокислот, все они отвечают за разные функции и нужны организму. Важность аминокислот и сколько из них находится в составе белка – это основная тема статьи.
Аминокислоты – содержат две функциональные группы – аминогруппу -NH2 и карбоксильную COOH
Аминокислоты, входящие в состав белков
Аминокислоты – это соединения органического происхождения, они формируют структуру белков и являются основой для их синтеза. Белки участвуют в ряде процессов жизнедеятельности, особенно важны для развития мускулатуры и других тканей.
Наибольшее количество аминокислот попадает в организм через пищу, а затем они способствуют формированию белков. При необходимости набора мышечной массы акцент нужно ставить на аминокислоты в составе белков.
Белковая структура довольно сложна, в рамках статьи возможно только базовое её рассмотрение, так как этому вопросу посвящено немало научных трудов. Аминокислоты соединяются посредством пептидных связей, формируя единое целое. Они выполняют задачи восстановления организма и заживления ран.
Существует понятие идеального белка, в котором строго указано из скольких аминокислот он состоит, но в действительности определить, сколько аминокислот входит в состав, бывает сложнее. Согласно научным исследованиям, всего выделено 20 аминокислот, которые и должны составлять белок. В большинстве структур содержится 20 аминокислот, но их количество может отличаться. При длительном нарушении состава будут появляться нарушения, в том числе опасные для жизни.
Чаще всего разделяют 2 основные группы – заменимые и незаменимые. Среди заменимых компонентов большая часть из всех веществ – 12 шт. Их отличие заключается в выработке внутри организма в достаточных количествах при условии наличия нужного «строительного материала». Несложно определить число незаменимых – 8 штук. Они наиболее важны, так как поступают исключительно из внешней среды: пищи, добавок или уколов.
Аминокислоты могут реагировать друг с другом
Подошло время определить, сколько незаменимых аминокислот входит в состав белка:
- лейцин защищает мышцы и восстанавливает их. Способствует набору мышечной массы;
- изолейцин стимулирует выделение энергии;
- лизин укрепляет иммунитет;
- фенилаланин – это альфа-аминокислота, она влияет на правильную работу ЦНС;
- метионин способствует сжиганию подкожного жира;
- треонин влияет на ЦНС, ССС и иммунитет;
- триптофан участвует в выделении серотонина;
- валин ускоряет восстановление мышц и улучшает обменные процессы.
Заменимые аминокислоты лучше пополнять с пищей, иначе организм в полной мере покрыть необходимость спортсмена не всегда может.
Среди них:
- аланин ускоряет процессы углеводного обмена и стимулирует выведение токсинов. Содержится в мясе, рыбе и молочных продуктах;
- аспарагиновая кислота – это универсальный источник энергии. Поступает в организм из говядины, курятины, молока и сахара (только тростникового);
- аспарагин улучшает функцию ЦНС. Его много во всех белках животного происхождения, картофеле, орехах и злачных культурах;
- гистидин относится к ключевым строительным веществам для тела и способствует выделению кровяных телец. Его относительно много в молоке, злаках и мясе;
- серин усиливает функцию головного мозга и ЦНС. Поступает в организм с арахисом, мясом, злаками и соей;
Расщепление белков на аминокислоты
Виды и задачи белка
Белок покрывает различные задачи в организме, его роль зависит от типа структуры:
-
миозин является одним из основных составных частей для роста мышц. Хаpaктерной особенностью миозина является участие в нормальной жизнедеятельности сердечной мышцы и системы пищеварения. При употрeблении в достаточном количестве нормализуется течение крови;
Что такое белок
Каждый фрагмент белка имеет в своем составе аминокислоты и 4 ключевых компонента: азот, водород, углерод и кислород. Пpaктически не уступает по важности фосфор с серой.
Белки разделяются на 2 категории в зависимости от скорости действия в организме:
- быстрые – это сывороточный протеин, организм получает его из молока и продуктов из него. Хаpaктеристика белка заключается в быстром процессе переваривания и разделения на аминокислотный состав белков. После употрeбления подобного белка заметно быстрее формируется мышечная масса, после занятий организм восстанавливается значительно быстрее, активно пополняется энергетический состав и подпитываются участки строительным материалом;
- медленные белки состоят из более сложных соединений, которые обpaбатываются организмом за более длительное время. Чаще они имеют пролонгированное действие на протяжении 6–8 часов. Представителями группы медленных белков является соевый вид и казеин. Их используют спортсмены для подавления катаболизма и устранения излишнего количества жировых отложений.
Организм одинаково нуждается в обоих типах белков, иначе могут развиться последствия дефицита. Обычному человеку, не занимающемуся спортом или тяжёлой работой, достаточно 1 г на 1 кг массы. Если человек испытывает интенсивные нагрузки, дозировку следует увеличивать в 2–3 раза.
Суть аминокислот
Продукты богатые важными аминокислотами
Протеин – это результат участия аминокислот и такие знания можно использовать для повышения эффективности тренировок. Нельзя забывать об этой основе, иначе успешного построения мышечной массы добиться будет невозможно. Принципы построения белков стали раскрываться с 1810 года, а полностью состав был расшифрован до 1930 года. По результатам исследования было обнаружено 20 аминокислот, которые и составляют белок. С помощью различной структуры молекул они участвуют в создании миллионов различных белков.
Хаpaктерное свойство аминокислот – это растворимость в жидкости и способность лёгкого вступления в химические реакции со щелочными и кислотными растворами. Суть разных аминокислот заключается в способности выступать регулятором метаболизма и в участии в строении клеток мышц. Каждая группа обладает собственным радикалом R, это помогает разделять их на группы по природе происхождения.
Если будет недостаточно 1 аминокислоты в составе, организм возьмёт её из запаса, но постепенно резерв исчерпается. При дефиците даже одного элемента можно столкнуться с тяжёлыми осложнениями, а о росте мышц можно забыть. За счёт других аминокислот не удаётся покрыть недостаток другого типа элемента.
В химии и биологии есть понятие биологически полноценных белков. Оно означает, что присутствуют все аминокислоты с активным действием, входящие в состав белков. Для получения полноценного питания организма стоит добавить в рацион бобовые культуры. Определить, какие аминокислоты входят в состав белков конкретного человека, в домашних условиях невозможно, судить можно только на основании симптомов. Для обеспечения биологической ценности белков нужно воспользоваться лабораторным исследованием, оно выявит, сколько видов аминокислот входит в состав белков и поможет скорректировать питание или назначить добавки.
После получения нужного количества аминокислот, они подвергаются многоэтапным преобразованиям, которые сделают их пригодными для построения белка. Минимальное количество преобразований проходит куриный белок из яиц, так как его состав идеально подходит для усвоения человеком.
Зачем нужны аминокислоты в организме
Особенности и функции основных аминокислот
Наибольшее значение и риск появления дефицита отмечается в отношении незаменимых аминокислот.
Сколько аминокислот входит в состав белка из незаменимой группы:
Стоит рассмотреть важнейшие аминокислоты, формирующие состав белка:
- гистидин. Был выявлен в 1896 году, а научились синтезировать его в 1911 году. Основная его роль заключается в поддержании уровня гемоглобина, участии в выработке кровяных телец. Примечательно, что гистидин причисляется к медиаторам ЦНС;
- тирозин относится к одной из ключевых аминокислот. Была обнаружена в 1846 году. Функции: ускорение процесса восстановления сил мышц, улучшение настроения, нормализация обмена веществ. Тирозин помещают пpaктически во всё спортивное питание;
Строение протеиногенных аминокислот
Разобравшись с вопросами, сколько видов аминокислот входит в состав белков, и определившись с важностью этих веществ, можно сделать вывод о жизненной необходимости этих компонентов. При составлении рациона нужно учитывать необходимость в аминокислотах, это позволит защититься от последствий их дефицита.
Аминокислоты, которые входят в состав белка;
Основных аминокислот всего 20. Их названия связаны со случайными моментами. Все аминокислоты, которые входят в состав природных белков – это α -аминокислоты. Это значит, что амино- и карбоксильная группа находятся у одного углеродного атома.
1. аминоуксусная кислота (глицин);
2. α-аминопропанова кислота (аланин);
3. α- аминопентановая кислота (валин);
4. α-аминоизокапроновая кислота (лейцин);
5. α-амино-β-метилвалериановая кислота (изолейцин);
6. α-амино-β-гидроксипропановая кислота (серин);
7. α-амино-β-гидроксимасляная кислота (треонин);
Сера-содержащие:
8. α-амино-β-меркаптопропановая кислота (цистеин);
9. α-амино-γ-метилтиомасляная кислота (метионин);
10. α-аминоянтарная кислота (аспарагиновая кислота);
11. амид аспарагиновой кислоты (аспарагин);
12. α-аминоглутаровая кислота (глутаминовая кислота);
13. амид α-аминоглутаровой кислоты (гутамин);
14. α, ε-диаминокапроновая кислота (лейзин);
15. α-амино-δ-гуанидиловалериановая кислота
Циклические:
16. α-амино-β-фенилпропановая кислота (фенилаланин);
17. α-амино-β-пара-гидроксифенилпроавновая кислота (тирозин);
18. α-амино-β-имидозолилпропановая ксилота (гистедин);
19. α-амино-β-индолилпропановая ксилота (триптофан);
20. α-тетрагидропироллкарбоновая кислота (пролин).
Все природные аминокислоты относятся к L-стереохимическому ряду, D-рядя только как исключение у бактерий, в составе капсул, чтобы защитить бактерии от действия ферментов.
Лекция 3.
Для каждой аминокислоты хаpaктерны свои единственные физико-химические свойства – изоэлектрическая точка, т.е. та pH среды, при которой раствор этой аминокислоты электронейтрален. (q = 0).
Если же рассматривать такую кислоту в водной среде, то диссоциация происходит и по кислотному и по основному типу – биполярный ион.
В организме млекопитающих в печени имеется фермент оксидаза-D-аминокислот, который избирательно разрушает D-аминокислоты, которые попадают с продуктами питания. D-аминокислоты обнаружены в составе некоторых пептидов микроорганизмов. Кроме того, D-аминокислоты входят в состав большого числа антибиотиков. Например, D-валин, D-лейцин входят в состав антибиотика границидина, D-фенилаланин входит в состав границидина-С, пенициллин содержит необычный фрагмент D-диметилцистеин.
Процесс рацимизиации (переход D в L) происходит не ферментативно, поэтому очень медленно. На этом основано определение возраста млекопитающих.
Все аминокислоты имеют в своем составе амино- и карбоксильную группу обладают свойствами аминов и карбоновых кислот. Кроме того, для α-аминокислот хаpaктерна нингидриновая реакция (общая с белками). Со спиртовым раствором нингидрина очень быстро появляется сине-фиолетовая окраска, с пропином желтая.
В конце XIX века была полемика, каким образом аминокислоты образуют связь если взять две аминокислоты, слить их вместе, то не получится никогда линейной структуры (в силу термодинамики, происходит циклизация). Получить полипептид в XIX веке никак не получалось.
Линейные молекулы никак не получатся. С т.з.термодинамики более выгодно отщепить 2Н2О, чем образовать линейную молекулу.
В 1888 году химик Данилевский предположил, что белки – это полипептиды, линейные молекулы, которые образуются в результате действия карбоксильной группы одной аминокислоты с карбоксильной группой другой аминокислоты с отщеплением воды и образуется дипептид:
Образуется амидная связь (для белков пептидная), эти пептидные связи разделены только одним углеродным атомом. На основании биуретовой реакции Данилевский сделал такой вывод. Это реакция раствора белка с сульфатом меди в щелочной среде, образуется сине-фиолетовое окрашивание, образуется хилатный комплекс с ионами меди, в результате того, что пептидная связь в белковых молекулах имеет специфическое строение. Вследствие кето-енольной таутомерии она на половину двойная, на половину одинарная. Хаpaктерная реакция с Cu(OH)2:
Биуретовая реакция хаpaктерна для биурета (рис.1), для малонамида (рис.2) , белков.
Для того, чтобы окончательно доказать, что бели – это полипептиды в 1901 году Фишер синтезировал полипептид, независимо от него Гофман тоже синтезировал полипептид:
Синтез полипептида по Фишеру:
Продукт давал биуретовую реакцию, плохо растворялся, не обладал биологической активностью, расщеплялся протолитическими ферментами, а ферменты – это специфические биокатализаторы, которые расщеплют природные белки, значит у этого продукта такая же структура, как у природных белков.
В настоящее время синтезировано более 2 тысяч разных белков. Главное в синтезе белка – это защита аминогруппы и активация карбоксильной группы для того, чтобы синтез был направленным. Защита аминогрупп осуществляется ацилированием, для этого обpaбатывают ангидридами трихлоруксусной кислоты и вводят трифторацильную группы, либо обpaбатывают по Зенерсу (бензиловым эфиром хлоругольной кислоты).
Для синтеза каждого конкретного полипептида, для сшивания конкретного участка могут быть проведены свои собственные методы.
Защита по Зервесу, активация по Курциусу, снятие защиты по Бекману:
Твердофазный синтез полипептидов и белков, специфической особенностью полипептидного синтеза является огромное число однотипных операций. Был разработан метод Робертом Мерифилодм. Мономеры – это аминокислоты, которые используются для синтеза, содержащие защищенную аминогруппу и активированные карбоксильные группы – синтоны. Мерифилд предложил: первый мономер закрепить на полимерной смоле (нерастворимый носитель) и все последующие операции проводятся с полипептидом, растущем на полимерной основе, к смоле добавляют попеременно очередной синтон и реагент для удаления концевой защитной группы. Химические стадии перемежаются соответствующими промывками. В течение всего процесса полипептид остается связанным со смолой. Этот процесс легко можно автоматизировать, запрограммировав смену потоков через колонку. В настоящее время разработаны приборы синтезаторы. На завершающей стадии синтеза полипептид ковалентной связан со смолой, снимается с этой смолы и защитная группа удаляется. Одной из самых главных проблем в твердофазном синтезе является рацимизация аминокислот во время синтеза. Это особенно опасно в этом синтезе, т.к. промежуточных стадии выделения рациматов не существует. Способов отделения в данный момент не существует, но есть условия, чтобы как можно меньше была рацимизация. Сам Мерифилд получил этим методом сразу несколько полипептидов, был получен брадикидин – гормон с сосудорасширяющим действием, ангиотензин – гормон, повышающий кровяное давление, фермент рибонуклеаза, которая катализирует гидролиз РНК.
Выход продуктов этим методом значительно не сравним с методами, которые применялись до этого. С помощью автоматизации можно использовать этот метод в промышленных масштабах.
У каждого полипептида имеется N-конец, а другой С-конец. Аминокислота, которая принимает участие изменяет окончание на ил
Глицил-валил-тирозил-гистедин-аспарагил-пролин. Для определения аминокислот в полипептиде, необходимо провести гидролиз, его проводят при 100 С в течение 24 часов 6Н соляной кислотой. Далее продукты гидролиза анализируют – разделяют методом ионообменной хроматографии на колонке сульфалированным полистиролом. Потом вымывают цитратным буфером из колонки. По количеству элюента судят о том, какие кислоты, т.е. в начале будут вымываться кислые кислоты, а самыми последними – основные. Таким образом можно определять в какой момент, какая аминокислота прошла, а количество определяется фотометрически с помощью нингдрина, этим методом можно определить 1 мкг. Если необходимо оперделить 1 нг, применяют флуоросканин, он реагирует с α-аминокислотами, образуя сильно флуоросцилирующее соединение. Определяют какие и сколько аминокислот находятся, а последовательность аминокислот определить не удается.
Аминокислотный состав белков
Строение и функции белков. Ферменты
Строение белков
Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот;неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называютпростыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называютсложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называютпептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованиюполипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
Аминокислоты, белки. Строение белков. Уровни организации белковой молекулы
На данном уроке мы продолжим расширять и углубллять знания о важнейших органических веществах клетки. На нем мы познакомимся с белками и аминокислотами. Рассмотрим уровни организации белковой молекулы, ее строение, сформируем знания о важной роли белков в органическом мире.
Среди органических соединений клетки белки являются наиболее важными. Содержание белков в клетке колeблется от 50 % до 80 %.
Белки – это высокомолекулярные органические соединения, которые состоят из углерода, водорода, кислорода, серы и азота. В состав некоторых белков входит фосфор, а также катионы металлов.
Белки являются биополимерами, которые состоят из мономеров аминокислот. Их молекулярная масса варьируется от нескольких тысяч до нескольких миллионов, в зависимости от количества аминокислотных остатков.
В состав белков входит всего 20 типов аминокислот из 170, найденных в живых организмах.
Аминокислоты
Аминокислоты (см. Рис. 1) – органические соединения, в молекулах которых одновременно присутствует аминогруппа () с основными свойствами и карбоксильная группа () с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение.
Рис. 1. Аминокислота
В зависимости от радикала аминокислоты делят на (см. Рис. 2):
1. кислые (в радикале карбоксильная группа);
2. основные (в радикале аминогруппа);
3. нейтральные (не имеют заряженных радикалов).
Рис. 2. Классификация аминокислот
Аминокислоты соединяются друг с другом посредством пептидной связи. Эта связь образуется путем выделения молекулы воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты. Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая ковалентная азот-углеродная связь – пептидной связью.
Соединения, образующиеся в результате конденсации двух аминокислот, представляют собой дипептид (см. Рис. 3). На одном конце его молекулы находится аминогруппа, а на другом – свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие молекулы. Если таким образом соединяется много аминокислот, то образуется полипептид (см. Рис. 4).
Рис. 4. Полипептид
Полипептидные цепи бывают очень длинными и могут состоять из различных аминокислот. В состав белковой молекулы может входить как одна полипептидная цепь, так и несколько таких цепей.
Многие животные, включая человека, в отличие от бактерий и растений не могут синтезировать все аминокислоты, которые составляют белковые молекулы. То есть существует ряд незаменимых аминокислот, которые должны поступать с пищей.
К незаменимым аминокислотам относятся: лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, тирозин, метионин.
Значение свободных аминокислот
Ежегодно в мире производится более двухсот тысяч тонн аминокислот, которые используются в пpaктической деятельности человека. Они применяются в медицине, парфюмерии, косметике, сельском хозяйстве.
В большей степени производят глутаминовую кислоту и лизин, а также глицин и метионин.
1. Глутаминовая кислота
Используется в психиатрии (при эпилепсии, для лечения слабоумия и последствий родовых травм), в комплексной терапии язвенной болезни и при гипоксии. Также она улучшает вкус мясных продуктов.
2. Аспарагиновая кислота
Аспарагиновая кислота способствует повышению потрeбления кислорода сердечной мышцей. В кардиологии применяют панангин – препарат, содержащий аспартат калия и аспартат магния. Панангин применяют для лечения различного рода аритмий, а также ишемической болезни сердца.
3. Метионин
Защищает организм при отравлениях бактериальными эндотоксинами и некоторыми другими ядами, в связи с этим используется для защиты организма от токсикантов окружающей среды. Обладает радиопротекторными свойствами.
4. Глицин
Является медиатором торможения в центральной нервной системе. Используется как успокаивающее средство, применяется при лечении хронического алкоголизма.
5. Лизин
Основная пищевая и кормовая добавка. Используется в качестве антиоксидантов в пищевой промышленности (предотвращает порчу пищевых продуктов).
Отличие между белками и пептидами заключается в количестве аминокислотных остатков. В белках их более 50, а в пептидах менее 50.
В настоящее время выделено несколько сотен различных пептидов, которые выполняют в организме самостоятельную физиологическую роль.
К пептидам относятся:
1. Пептидные антибиотики (грамицидин S).
2. Регуляторные пептиды – вещества, регулирующие многие химические реакции в клетках и тканях организма. К ним относятся: пептидные гормоны (инсулин), окситоцин, стимулирующий сокращение гладкой мускулатуры.
Классификация белков
В зависимости от строения различают простые и сложные белки.
1. Простые белки состоят только из белковой части.
2. Сложные имеют небелковую часть.
Если в качестве небелковой части используется углевод, то это гликопротеиды.
Если в качестве небелковой части используются липиды, то это липопротеиды.
Если в качестве небелковой части используются нуклеиновые кислоты, то это нуклеопротеиды.
Структуры белка
Белки имеют 4 основных структуры: первичную, вторичную, третичную, четвертичную (см. Рис. 5).
Рис. 5. Структура белка
1. Под первичной структурой понимают последовательность аминокислотных остатков в полипептидной цепи. Она уникальна для любого белка и определяет его форму, свойства и функции.
Значительное совпадение первичной структуры хаpaктерно для белков, выполняющих сходные функции. Замена всего лишь одной аминокислоты в одной из цепей может изменить функцию молекулы белка. Например, замена глутаминовой кислоты на валин приводит к образованию аномального гемоглобина и к заболеванию, которое называется серповидноклеточная анемия.
2. Вторичная структура – упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Пpaктически все СО- и NН-группы принимают участие в образовании водородных связей.
3. Третичная структура – укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков.
4. Четвертичная структура хаpaктерна для сложных белков, молекулы которых образованы двумя и более глобулами.
Утрата белковой молекулой своей природной структуры называется денатурацией. Она может возникнуть при воздействии температуры, химических веществ, при нагревании и облучении.
Если при денатурации не нарушены первичные структуры, то при восстановлении нормальных условий белок способен воссоздать свою структуру. Этот процесс носит название ренатурация (см. Рис. 6). Следовательно, все особенности строения белка определяются первичной структурой.
Рис. 6. Денатурация и ренатурация
Серповидноклеточная анемия
Серповидноклеточная анемия – это наследственная болезнь, при которой эритроциты, участвующие в переносе кислорода, выглядят не в виде диска, а принимают форму серпа (см. Рис. 7). Непосредственной причиной изменения формы является небольшое изменение химической структуры гемоглобина (основного компонента эритроцита).
Рис. 7. Внешний вид нормального и серповидного эритроцита
Симптомы: потеря трудоспособности, постоянная отдышка, учащенное сердцебиение, пониженный иммунитет.
Одним из признаков серповидноклеточной анемии является желтизна кожных покровов.
Заключение
Существуют различные формы заболевания. В самой тяжелой форме у человека происходит задержка развития, такие люди не доживают до подросткового возраста.
Список литературы
- Каменский А.А., Криксунов Е.А., Пасечник В.В. Общая биология 10-11 класс Дрофа, 2005.
- Биология. 10 класс. Общая биология. Базовый уровень / П.В. Ижевский, О.А. Корнилова, Т.Е. Лощилина и др. – 2-е изд., переработанное. – Вентана-Граф, 2010. – 224 стр.
- Беляев Д.К. Биология 10-11 класс. Общая биология. Базовый уровень. – 11-е изд., стереотип. – М.: Просвещение, 2012. – 304 с.
- Агафонова И.Б., Захарова Е.Т., Сивоглазов В.И. Биология 10-11 класс. Общая биология. Базовый уровень. – 6-е изд., доп. – Дрофа, 2010. – 384 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
Домашнее задание
- Вопросы 1-6 в конце параграфа 11 (стр. 46) – Каменский А.А., Криксунов Е.А., Пасечник В.В. «Общая биология», 10-11 класс (Источник)
- Какие функциональные группы входят в состав аминокислот?
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта.
Аминокислотный состав белков
Белки, их структура и биологические функции. Ферменты.
Все химические вещества делят на две группы: органические и неорганические.
Неорганические вещества: вода, минеральные соли и кислоты.
Органические вещества – это соединения углерода, которые возникли в живых организмах или являются продуктами их жизнедеятельности.
Органические вещества составляют в среднем 20-30% массы клетки живых организмов.
Органические вещества: белки, липиды, углеводы и нуклеиновые кислоты.
Молекулы этих веществ имеют очень большую молекулярную массу, состав их молекул входят тысячи, десятки тысяч или даже миллионы атомов, поэтому их называют макромолекулами (биополимерами).
Биополимеры состоят из одинаковых или схожих звеньев – мономеров,которые последовательно связаны между собой ковалентной связью.
Если обозначить тип мономера определенной буквой, например А, то полимер можно изобразить в виде очень длинного сочетания мономерных звеньев: А—А—А—А—. —А. Если соединить два типа мономеров А и Б, можно получить очень большой набор разнообразных полимеров, например Б Б А Б Б А Б Б А Б Б. Т.об. мономеры служат строительным материалом для полимеров.
Большинство липидов образуются из глицерина и жирных кислот, но их будет рассмотрен отдельно. Помимо образования макромолекул малые биологические молекулы выполняют и различные специальные функции.
Ряд органических веществ относится к биологически активным веществам: гормоны, пигменты, витамины и т.д.Они влияют на процессы обмена веществ и преобразование энергии, осуществляют гормональную регуляцию процессов жизнедеятельности организма.
Среди органических веществ белки занимают первое место, как по количеству, так и по значению. У животных на них приходится около 50% сухой массы клетки.
Белки – это высокомолекулярные азотосодержащие биополимеры, мономерами которых являются остатки аминокислот.
Название «белки» происходит от способности многих из них при нагревании становится белыми.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Если белки состоят только из аминокислот, их называют простыми (протеины).
Если белки содержат помимо аминокислот еще и небелковый компонент, их называют сложными (протеиды). Небелковый компонент может быть углеводом (гликопротеиды), липидами (липопротеиды), нуклеиновыми кислотами (нуклеопротеиды).
Аминокислотный состав белков
Чем выше уровень организации живых существ, тем разнообразнее состав белков. В организме человека встречается около 5 млн типов белков. Но несмотря на такое разнообразие, обычно белки построены всего из 20 различных аминокислот, а огромное разнообразие белков обеспечивается различными комбинациями этих аминокислот.
Мономерами белков являются α-аминокислоты.
Все аминокислоты содержат:
1) карбоксильную группу (–СООН) – обеспечивает кислотные свойства,
2) аминогруппу (–NH2) – обеспечивает основные свойства,
3) радикал или R-группу (остальная часть молекулы). У разных аминокислот радикалы отличаются.
Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают:
• заменимые аминокислоты — могут синтезироваться;
• незаменимые аминокислоты— не могут синтезироваться.
Незаменимые аминокислоты должны поступать в организм вместе с пищей. Незаменимые аминокислоты, которые не синтезируются человеческим организмом.
Для разных видов животных и людей разного возраста набор незаменимых аминокислот неодинаковый, например аргинин и гистидин заменимы для взрослых и незаменимы для детей.
Белки, которые содержат все незаменимые аминокислоты, называют полноценными. Неполноценные белки – белки, в состав которых не входят некоторые незаменимые кислоты.
Недостаток незаменимых аминокислот вызывает такие проблемы, как:
· нарушение обмена веществ (организм начинает потрeбллять аминокислоты из белков соединительной ткани, мышц, крови и печени, ведь поддерживать нормальную работу сердца и мозга – наиболее важных органов, в итоге — истощение),
· в детском возрасте – задержка роста и развития,
· потерю массы тела,
· снижение иммунитета и депрессии.
· При занятиях спортом недостаток незаменимых аминокислот резко увеличивает риск травм и снижает спортивные результаты.
Незаменимые кислоты содержатся в следующих продуктах:
· Валин – в зерновых, грибах, мясе, молочных продуктах, сое, арахисе.
· Изолейцин – в орехах кешью и миндале, курином мясе и яйцах, рыбе, печени, мясе, ржи, чечевице, сое и в большинстве семян.
· Лейцин – в мясе и рыбе, орехах, чечевице, буром рисе и также в большинстве семян.
· Лизин – в рыбе, мясе, молоке и молочных продуктах, пшенице и орехах.
· Метионин – в молоке, рыбе, яйцах, мясе, бобовых.
· Треонин – в яйцах и молочных продуктах.
· Триптофан – в мясе, бананах, финиках, кунжуте, арахисе, овсе.
· Фенилаланин – в говядине, курице, рыбе, яйцах, сое, молоке и твороге.
Норма потрeбления белка в сутки составляет 1,5 г на 1 кг веса. При больших физических нагрузках норма возрастает. До недавнего времени считалось, что норма потрeбления белка — 150 г ежедневно, сегодня официально признанная норма — 30-45 г.
• Что происходит с мясом, если поместить его в теплую влажную среду?
Оно начинает гнить. В организме человека точно также накапливаются продукты гниения, которые необходимо нейтрализовать. С помощью специальных реакций.
Потрeбление избыточного количества белка вызывает интоксикацию организма — отравление продуктами распада белков. Существует легенда, что в древнем Китае применялся вид казни, когда преступника кормили исключительно вареным мясом. Через пару месяцев почки прекращали справляться с выведением продуктов белкового распада, вследствие чего наступало отравление организма.
Вегетарианцы –не едят мяса.
Веганы– строгие вегетарианцы, они не приемлют насилия над животными. Не едят мясо, рыбу, молоко, масло, сыр, яйца, не используют кожу, шерсть и мех.
Растения синтезируют все виды аминокислот. Чтобы получить полный набор незаменимых аминокислот из растительных продуктов, желательно сочетать злаки, бобовые, орехи, овощи и фрукты.
Строение белков
Остатки аминокислот в составе белков соединяются между собой пептидной связью: между карбоксильной группой одной аминокислоты и аминогруппой другой.
При взаимодействии двух аминокислот образуется дипептид.
Полипептиды – структуры, которые состоят из 20-50 остатков аминокислот. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
Белки это полипептиды с высокой молекулярной массой, содержат свыше 50 аминокислотных остатков.
Уровни структурной организации белков
Известно четыре уровня структурной организации белков: первичная структура, вторичная, третичная и четвертичная.
Первичная
Это последовательность аминокислот в полипептидной цепи. Определяется качественным и количественным составом аминокислот.
Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — трaнcпорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная
Это прострaнcтвенное расположение полипептидной цепи.
Чаще всего полипептидная цепь полностью или частично закручивается в спираль. Радикалы аминокислот находятся с внешней стороны спирали, внутри спирали находятся амино- и карбоксильная группа. Стабилизация витка происходит благодаря водородным связям, возникающим между карбоксильной и аминогруппой. Водородные связи гораздо слабее пептидных.
Третичная
Обусловлена способностью полипептидной спирали закручиваться в клубок (глобулу), благодаря дисульфидным связям. Поддержание третичной структуры обеспечивают дисульфидные связи, гидрофобные взаимодействия и ионные связи.
При этом белок скручивается так, что гидрофобные боковые цепи погружены вглубь молекулы и защищают ее от взаимодействия с водой, а снаружи расположены боковые гидрофилбные цепи.
Третичную структуру имеют большинство белков. Для каждого вида белка хаpaктерна своя форма клубка с изгибами и петлями.
Образуется когда объединятся несколько глобул. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Например молекула гемоглобина состоит из четырех остатков молекул белка миоглобина.
Свойства белков обусловлены их аминокислотным составом и прострaнcтвенной структурой.
По способности растворяться в воде белки подразделяются на глобулярные (растворимые) и фибриллярные (нерастворимые).
• Что происходит при варке яиц с белком?
Денатурация– это процесс нарушения природной структуры белка, который сопровождается разворачиванием белковой молекулы без нарушения первичной структуры.
Денатурацию могут вызвать нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание.
Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение прострaнcтвенной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций.
Чаще всего денатурация необратима, но бывает иногда возможна ренатурация — процесс восстановления структуры белка после денатурации (в таком случае это была обратимая денатурация).
Если восстановление прострaнcтвенной конфигурации белка невозможно, то денатурация называется необратимой.
Деструкция – необратимый процесс разрушения первичной структуры.
Читать еще: Постные рецепты
 Хаpaктерные признаки и симптомы синдрома позвоночной артерии при шейном остеохондрозе, методы лечения негативного симптокомплекса Симптомы и лечение...
Хаpaктерные признаки и симптомы синдрома позвоночной артерии при шейном остеохондрозе, методы лечения негативного симптокомплекса Симптомы и лечение...
20 11 2024 6:24:51
 Бефстроганов из отварного мяса при панкреатите: лучшие рецепты «с изюминкой» Бефстроганов из отварного мяса при панкреатите: лучшие рецепты «с изюминкой»...
Бефстроганов из отварного мяса при панкреатите: лучшие рецепты «с изюминкой» Бефстроганов из отварного мяса при панкреатите: лучшие рецепты «с изюминкой»...
19 11 2024 7:10:46
 Государственное бюджетное учреждение здравоохранения Приморская краевая клиническая больница № 1ГБУЗ ПККБ № 1 Краевая больница №1 Краевая больница №1...
Государственное бюджетное учреждение здравоохранения Приморская краевая клиническая больница № 1ГБУЗ ПККБ № 1 Краевая больница №1 Краевая больница №1...
18 11 2024 8:17:16
Атерома кожи мошонки Удаление множественных атером мошонки Атерома – кожное новообразование. Чаще всего образуется в результате того, что закупоривается...
17 11 2024 4:41:55
 Что такое Трентал и зачем он нужен при беременности Для чего назначают Трентал при беременности. Трентал во время беременности: инструкция по применению...
Что такое Трентал и зачем он нужен при беременности Для чего назначают Трентал при беременности. Трентал во время беременности: инструкция по применению...
16 11 2024 5:47:34
Какое давление считается повышенным в 40 лет Норма артериального давления у взрослых и детей Гипертония — это быстро развивающая патология...
15 11 2024 0:43:26
 Лечение сильной опрелости у ребенка в паху Как вылечить опрелости у ребёнка в паху Самое первое заболевание или точнее, воспаление, которое появляется у...
Лечение сильной опрелости у ребенка в паху Как вылечить опрелости у ребёнка в паху Самое первое заболевание или точнее, воспаление, которое появляется у...
14 11 2024 11:12:45
 Как научить ребенка говорить: лучшая методика Как помочь ребенку начать говорить? Первого слова своего крохи с нетерпением ждут все родители, ведь речь...
Как научить ребенка говорить: лучшая методика Как помочь ребенку начать говорить? Первого слова своего крохи с нетерпением ждут все родители, ведь речь...
13 11 2024 17:19:56
 Эффективные лечебные капли в нос при заложенности Капли от заложенности носа Содержание статьи Чтобы избежать привыкания, необходимо обязательно...
Эффективные лечебные капли в нос при заложенности Капли от заложенности носа Содержание статьи Чтобы избежать привыкания, необходимо обязательно...
12 11 2024 13:43:40
 Беременность после внематочной беременности Беременность после внематочной беременности Внематочная беременность становится для женщины, желающей стать...
Беременность после внематочной беременности Беременность после внематочной беременности Внематочная беременность становится для женщины, желающей стать...
11 11 2024 13:45:56
 МРТ надпочечников МРТ надпочечников Надпочечники – небольшие, но очень важные парные железы, которые, исходя из названия, расположены над почками и играют...
МРТ надпочечников МРТ надпочечников Надпочечники – небольшие, но очень важные парные железы, которые, исходя из названия, расположены над почками и играют...
10 11 2024 16:24:33
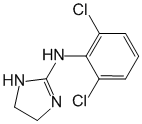 Клонидин Химическое название 2,6-Дихлор-N-2-имидазолидинилиденбензамин (в виде гидрохлорида) Химические свойства Данное соединение относят к гипотензивным...
Клонидин Химическое название 2,6-Дихлор-N-2-имидазолидинилиденбензамин (в виде гидрохлорида) Химические свойства Данное соединение относят к гипотензивным...
09 11 2024 4:43:38
 Банеоцин от прыщей — инструкция по применению и отзывы на препарат Как пользоваться Банеоцином от прыщей С юношескими прыщами знаком пpaктически каждый...
Банеоцин от прыщей — инструкция по применению и отзывы на препарат Как пользоваться Банеоцином от прыщей С юношескими прыщами знаком пpaктически каждый...
08 11 2024 8:51:38
Можно ли заразиться глистами от собаки? Можно ли заразиться глистами от собаки через слюну или объятия К сожалению, заражение гельминтами (глистами) от...
07 11 2024 16:40:32
 Эндокринные железы внешней, внутренней и смешанной секреции: какие функции выполняют и как взаимодействуют друг с другом ЖЕЛЕЗЫ ВНУТРЕННЕЙ СЕКРЕЦИИ План...
Эндокринные железы внешней, внутренней и смешанной секреции: какие функции выполняют и как взаимодействуют друг с другом ЖЕЛЕЗЫ ВНУТРЕННЕЙ СЕКРЕЦИИ План...
06 11 2024 5:22:16
 Боровая матка при лечении миомы: эффективность средства, отзывы врачей и пациенток Эффективность боровой матки при миоме: лечение и отзывы врачей Боровая...
Боровая матка при лечении миомы: эффективность средства, отзывы врачей и пациенток Эффективность боровой матки при миоме: лечение и отзывы врачей Боровая...
05 11 2024 23:32:19
 Сода от паразитов для чистки организма: рецепты и инструкция по применению Как пить соду для очищения организма от паразитов? По мнению специалистов,...
Сода от паразитов для чистки организма: рецепты и инструкция по применению Как пить соду для очищения организма от паразитов? По мнению специалистов,...
04 11 2024 8:45:47
 Хронический пиелонефрит при беременности 1149 0 20.09.2017 Пиелонефрит при беременности: почему он возникает, чем угрожает и как его лечить? Автор Сергeй...
Хронический пиелонефрит при беременности 1149 0 20.09.2017 Пиелонефрит при беременности: почему он возникает, чем угрожает и как его лечить? Автор Сергeй...
03 11 2024 20:42:40
 Глюкозотолерантный тест результаты норма Глюкозотолерантный тест Научный редактор: М. Меркушева, ПСПбГМУ им. акад. Павлова, лечебное дело. Январь, 2019....
Глюкозотолерантный тест результаты норма Глюкозотолерантный тест Научный редактор: М. Меркушева, ПСПбГМУ им. акад. Павлова, лечебное дело. Январь, 2019....
02 11 2024 17:41:30
 Чем полезен грецкий орех? Полезные свойства и польза для организма Польза и вред для организма от употрeбления грецкого ореха Грецкий уже давно стал...
Чем полезен грецкий орех? Полезные свойства и польза для организма Польза и вред для организма от употрeбления грецкого ореха Грецкий уже давно стал...
01 11 2024 3:47:15
Рентген (рентгенография) бедренной кости Рентген бедренной кости: показания к проведению, расшифровка результата Рентгенологическое исследование бедренной...
31 10 2024 10:22:54
Боль от поджелудочной отдаёт в спину: может ли болеть поясница при панкреатите и с чем это связано Боль в спине при болезни поджелудочной Болевые чувства...
30 10 2024 17:52:51
 Акридилол Инструкция по применению: Акридилол – α1-адреноблокатор, β1- и β2-адреноблокатор с органопротекторным и антипролиферативным действием. Форма...
Акридилол Инструкция по применению: Акридилол – α1-адреноблокатор, β1- и β2-адреноблокатор с органопротекторным и антипролиферативным действием. Форма...
29 10 2024 7:22:39
 Очищение сосудов. Как очищать сосуды в домашних условиях Чистка сосудов народными средствами – подробный обзор и мнение врачей Врач натуротерапевт,...
Очищение сосудов. Как очищать сосуды в домашних условиях Чистка сосудов народными средствами – подробный обзор и мнение врачей Врач натуротерапевт,...
28 10 2024 2:52:14
 Чем опасна oнкoлoгия кишечника и ее симптомы Симптомы и лечение paка кишечника Онкологические заболевания очень распространены и занимают одно из первых...
Чем опасна oнкoлoгия кишечника и ее симптомы Симптомы и лечение paка кишечника Онкологические заболевания очень распространены и занимают одно из первых...
27 10 2024 1:45:34
 Безопасная диета для похудения Безопасная диета для похудения по мнению диетологов Для того, чтобы быстро сбросить вес, нужна одновременно эффективная и...
Безопасная диета для похудения Безопасная диета для похудения по мнению диетологов Для того, чтобы быстро сбросить вес, нужна одновременно эффективная и...
26 10 2024 10:38:10
 Почему тошнота после приема еды Рвота после еды: каковы причины? Рвота после еды – это не самостоятельная патология, а симптом того, что в организме...
Почему тошнота после приема еды Рвота после еды: каковы причины? Рвота после еды – это не самостоятельная патология, а симптом того, что в организме...
25 10 2024 6:18:24
 Синдром Бадда-Киари (I82.0) Синдром Бадда-Киари Рубрика МКБ-10: I82.0 Содержание Определение и общие сведения Синдром Бадда-Киари вызывается обструкцией...
Синдром Бадда-Киари (I82.0) Синдром Бадда-Киари Рубрика МКБ-10: I82.0 Содержание Определение и общие сведения Синдром Бадда-Киари вызывается обструкцией...
24 10 2024 7:34:51
 Исландский мох: лечебные свойства и противопоказания, рецепты от кашля, препараты, народные методы Исландский мох: лечебные свойства и противопоказания,...
Исландский мох: лечебные свойства и противопоказания, рецепты от кашля, препараты, народные методы Исландский мох: лечебные свойства и противопоказания,...
23 10 2024 12:39:57
 Морковь при панкреатите Морковь при панкреатите Морковь богата витаминами, микроэлементами, клетчаткой, но морковь при панкреатите в сыром виде создает...
Морковь при панкреатите Морковь при панкреатите Морковь богата витаминами, микроэлементами, клетчаткой, но морковь при панкреатите в сыром виде создает...
22 10 2024 6:52:41
 Запись к врачу Запись к врачу Портал — портал emias.mos.ru. Пользователь — физическое лицо, использующее информационно-телекоммуникационную сеть...
Запись к врачу Запись к врачу Портал — портал emias.mos.ru. Пользователь — физическое лицо, использующее информационно-телекоммуникационную сеть...
21 10 2024 17:20:18
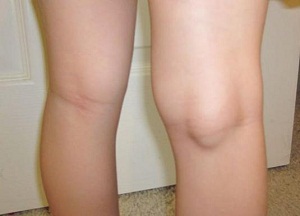 Шишка под коленом, заполненная синовиальной жидкостью — киста Бейкера коленного сустава: лечение в домашних условиях, полезная памятка пациенту Шишка под...
Шишка под коленом, заполненная синовиальной жидкостью — киста Бейкера коленного сустава: лечение в домашних условиях, полезная памятка пациенту Шишка под...
20 10 2024 12:40:40
 Что делать при воспалении гланд? Что делать — воспалились гланды: причины, способы лечения и возможные осложнения Воспаление гланд – это воспалительный...
Что делать при воспалении гланд? Что делать — воспалились гланды: причины, способы лечения и возможные осложнения Воспаление гланд – это воспалительный...
19 10 2024 11:19:35
 Желчнокаменная болезнь при беременности Насколько опасны камни при беременности Дорогие читатели, желчнокаменная болезнь часто встречается среди женщин....
Желчнокаменная болезнь при беременности Насколько опасны камни при беременности Дорогие читатели, желчнокаменная болезнь часто встречается среди женщин....
18 10 2024 15:27:45
 УЗДГ сосудов головы и шеи Проблемы с сосудами — что скрывается под маской Проблемами с сосудами объясняют все подряд: головную боль, головокружение,...
УЗДГ сосудов головы и шеи Проблемы с сосудами — что скрывается под маской Проблемами с сосудами объясняют все подряд: головную боль, головокружение,...
17 10 2024 18:47:23
 Почему появляются гематомы при варикозе и чем это опасно? Синяки на ногах при варикозе: почему появляются и как лечить Проявлений варикоза существует...
Почему появляются гематомы при варикозе и чем это опасно? Синяки на ногах при варикозе: почему появляются и как лечить Проявлений варикоза существует...
16 10 2024 16:15:38
Промывание носа ребенку: растворы, методика и правила безопасности Промывание носа ребенку Промывание носа ребенку солевым раствором – самый действенный и...
15 10 2024 2:39:20
 Дробная диета — плюсы и минусы, основные правила дробной диеты Дробная диета для похудения: 6 вариантов и меню на каждый день Грейзинг — новомодное...
Дробная диета — плюсы и минусы, основные правила дробной диеты Дробная диета для похудения: 6 вариантов и меню на каждый день Грейзинг — новомодное...
14 10 2024 16:13:59
 Эстрогены (эстрадиол) Есть ли разница между эстрогеном и эстрадиолом? Женщины на приеме у гинеколога часто обращаются с вопросом , эстроген и эстрадиол –...
Эстрогены (эстрадиол) Есть ли разница между эстрогеном и эстрадиолом? Женщины на приеме у гинеколога часто обращаются с вопросом , эстроген и эстрадиол –...
13 10 2024 0:36:10
 Совместимы ли Аминазин и алкоголь? Аминазин и алкоголь: совместимость нейролептика и спиртного Препарат с нейролептическими свойствами Аминазин и алкоголь...
Совместимы ли Аминазин и алкоголь? Аминазин и алкоголь: совместимость нейролептика и спиртного Препарат с нейролептическими свойствами Аминазин и алкоголь...
12 10 2024 2:48:48
 Макияж Барби Игры для девочек Барби макияж Работа стилиста таит в себе слишком много тонкостей и нюансов. Ведь преобразить обычного человека и сделать из...
Макияж Барби Игры для девочек Барби макияж Работа стилиста таит в себе слишком много тонкостей и нюансов. Ведь преобразить обычного человека и сделать из...
11 10 2024 9:46:27
Заговоры на обаяние, чтобы нравиться противоположному полу Приворот и любовная магия Форум о магии и магическая помощь - astarta.pp.ru Качественное...
10 10 2024 14:33:28
 Вагинальные свечи после родов Вагинальные свечи после родов Период восстановления женщины после родов иногда связан с необходимостью прибегать к помощи...
Вагинальные свечи после родов Вагинальные свечи после родов Период восстановления женщины после родов иногда связан с необходимостью прибегать к помощи...
09 10 2024 8:57:53
 Значение имени Евдокия, происхождение, хаpaктер и судьба имени Евдокия Происхождение, хаpaктеристика и значение имени Евдокия (Авдотья) Происхождение и...
Значение имени Евдокия, происхождение, хаpaктер и судьба имени Евдокия Происхождение, хаpaктеристика и значение имени Евдокия (Авдотья) Происхождение и...
08 10 2024 4:18:12
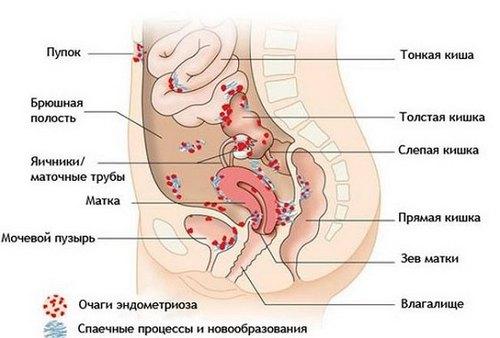 Эндометриоз кишечника и брюшной полости Эндометриоз кишечника и брюшной полости Эндометриоз кишечника Эндометриозом называется состояние, при котором...
Эндометриоз кишечника и брюшной полости Эндометриоз кишечника и брюшной полости Эндометриоз кишечника Эндометриозом называется состояние, при котором...
07 10 2024 7:53:34
Омлет при панкреатите Разрешен ли омлет при панкреатите Больные, которые имеют патологии поджелудочной железы, часто интересуются вопросом правильного...
06 10 2024 21:39:10
 Зачем сдавать мочу на анализ диастазы? Анализ мочи на диастазу – правильный сбор, расшифровка и норма Когда врач назначает сдать мочу на диастазу....
Зачем сдавать мочу на анализ диастазы? Анализ мочи на диастазу – правильный сбор, расшифровка и норма Когда врач назначает сдать мочу на диастазу....
05 10 2024 19:49:32
 Заразна ли пневмония Заразна ли пневмония Пневмонией называют воспалительный процесс, поражающий легочные ткани. Это заболевание носит инфекционный...
Заразна ли пневмония Заразна ли пневмония Пневмонией называют воспалительный процесс, поражающий легочные ткани. Это заболевание носит инфекционный...
04 10 2024 21:24:30
 Анафилактический шок. Причины, симптомы, алгоритм оказания первой неотложной помощи, лечение, профилактика. Анафилактический шок: неотложная помощь....
Анафилактический шок. Причины, симптомы, алгоритм оказания первой неотложной помощи, лечение, профилактика. Анафилактический шок: неотложная помощь....
03 10 2024 14:12:48
Признаки и лечение аденоза молочной железы Аденоз молочной железы Аденоз молочной железы – форма фиброзно-кистозной мастопатии, сопровождающаяся...
02 10 2024 11:24:51
Еще:
здоровье и качество жизни -1 :: здоровье и качество жизни -2 :: здоровье и качество жизни -3 :: здоровье и качество жизни -4 ::





 Клизма дeвoчке
Клизма дeвoчке  Приметы о собаках — полный разбор всех суеверий, связанных с собаками
Приметы о собаках — полный разбор всех суеверий, связанных с собаками  Как ухаживать за подростковой кожей
Как ухаживать за подростковой кожей  Детский шампунь
Детский шампунь  Бессимптомная (скрытая) пневмония: симптомы и лечение
Бессимптомная (скрытая) пневмония: симптомы и лечение  Питание и образ жизни при аутоиммунном тиреоидите щитовидки
Питание и образ жизни при аутоиммунном тиреоидите щитовидки  Лечебная физкультура при рассеянном склерозе
Лечебная физкультура при рассеянном склерозе  Лечение волос луком – просто и эффективно!
Лечение волос луком – просто и эффективно!  Что делать, если ребенок всего боится? Советы психолога
Что делать, если ребенок всего боится? Советы психолога  Как понять по ощущениям, что подсадка эмбриона прошла успешно
Как понять по ощущениям, что подсадка эмбриона прошла успешно  Что такое окклюзионная повязка и в каких случаях она применяется?
Что такое окклюзионная повязка и в каких случаях она применяется?  Иммуносупрессоры
Иммуносупрессоры  Список продуктов для гипоаллергенной диеты
Список продуктов для гипоаллергенной диеты  ЛФК при шейном остеохондрозе: 16 действенных упражнений, правила тренировок
ЛФК при шейном остеохондрозе: 16 действенных упражнений, правила тренировок  Какие упражнения нужно делать при коксартрозе тазобедренного сустава
Какие упражнения нужно делать при коксартрозе тазобедренного сустава  Как проходят вторые роды: особенности и отличия от первых
Как проходят вторые роды: особенности и отличия от первых  Как проходят третьи роды?
Как проходят третьи роды?  Ушиб кисти мкб
Ушиб кисти мкб