Марганец
Марганец
Марганец -общая хаpaктеристика элемента, химические свойства хрома и его соединений
Марганец — элемент 4-го периода и VII B-группы Периодической системы, порядковый номер 25. Электронная формула атома [18Аr]Зd 5 4s 2 ; хаpaктерные степени окисления + VII,+ VI, +IV, +III, +II и 0.
Шкала степеней окисления марганца:
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Мg) и неметаллами (F, O,N, Cl). Соединения Мn ‖‖ — оксид и гидроксид — проявляют основные свойства, соединения Мn ‖‖‖ и Мn IV — амфотерные свойства, для соединений Мn VI и Мn VII хаpaктерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения.
В природе — четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец Мn. Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
Mn+Cl2→MnCl2 , (200 o C) Mn+S→ MnS (до1580 o C)
В ряду напряжений марганец стоит левее водорода, из разбавленных кислот НCl и Н2SO4 вытесняет водород:
Взаимодействует с кислотами-окислителями при нагревании, также образуя соли марганца (II):
Получение марганца в промышленности — восстановление пиролюзита МnO2 или гаусманита (Мn II Mn II I )O4 коксом или алюминием:
Наиболее чистый марганец выделяют электролизом раствора из солей марганца (П), например:
Промышленно важен сплав с железом — ферромарганец (> 70 % Мn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) МnO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата МnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и Н2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее хаpaктерны свойства восстановителя.
Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
Уравнения важнейших реакций:
В природе самое распространенное соединение марганца — минерал пиролюзит
Манганат калия К2MnO4. Оксосоль. Темно-зеленый, плавится под избыточным давлением О2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону МnO4 2- . Медленно разлагается при разбавлении раствора водой, быстро — при подкислении. Проявляет окислительно-восстановительные свойства.
Качественная реакция — появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
Уравнения важнейших реакций:
Получение: сплавление МnO2 с сильными окислителями (KNO3, КClO3).
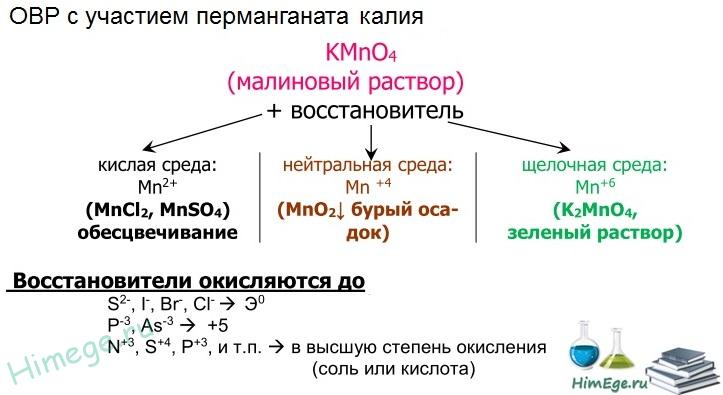
Перманганат калия КМnO4. Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно-фиолетовая окраска раствора отвечает иону МnO4), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до Мn II , в нейтральной среде – до Mn IV в сильнощелочной среде — до Мn VI
Качественная реакция на ион МnO4 — исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной пpaктике. Уравнения важнейших реакций:
МnO4 — + 8Н + + 5Fе 2+ = Мn 2+ + 5Fе 3+ + 4Н2O
Что такое марганец? Свойства марганца. Применение марганца
Что такое марганец?
Марганец – элемент таблицы Менделеева . Принадлежит VII группе. Расположен в четвертом периоде между хромом и железом. Имеет 25-й атомный номер. Формула марганца [Ar] 3d 5 4s 2 .
Был открыт в 1774 году. Атом марганца весит 54,938045. Содержит изотоп 55Mn, а природный марганец состоит полностью из него. Степень окисления металла колeблется от 2 до 7. Электроотрицательность Mn — 1,55. Переходный материал.
Соединения марганец 2 образуют оксид и диоксид. Проявляют основные свойства элемента. Образования марганец 3 и марганец 4 отличаются амфотерными свойствами. В комбинациях металла 6 и 7 лидируют свойства кислоты марганца. Элемент № 25 образует многочисленные виды солей и различные бинарные соединения.
Добыча марганца ведется повсеместно как в России, так и в ближнем зарубежье. На Украине существует особый Марганец – город, расположенный на многочисленных образованиях марганцевой руды.
Описание и свойства марганца
Серебристо-белый цвет с легким серым налетом выделяет марганец. Состав элемента имеет примесь углерода, которая дает ему серебристо-белый цвет. Он превосходит железо по твердости и хрупкости. В виде мелких абразивов пирофорен.
При взаимодействии с воздушной средой происходит окисление марганца. Покрывается оксидной пленкой, защищающей его от последующей окислительной реакции.
Растворяется в воде, полностью поглощает водород, не вступая в реакцию с ним. В процессе нагревания сгорает в кислороде. Активно реагирует с хлором и серой. При взаимодействии с кислотными окислителями образует соли марганца.
Плотность — 7200 кг/м3, t плавления — 1247°С, t кипения — 2150 °С. Удельная теплоемкость — 0,478 кДж. Обладает электрической проводимостью. Контактируя с хлором, бромом и йодом образует дигалогениды.
При высоких температурах вступает во взаимодействие с азотом, фосфором, кремнием и бором. Медленно взаимодействует с холодной водой. В процессе нагревания реакционная способность элемента возрастает. На выходе образуется Mn(OH)2 и водород. При соединении марганца с кислородом образуется оксид марганца. Выделяют семь его групп:
Оксид марганца (II). Монооксид. Не взаимодействует с водой. Легко окисляется, образуя хрупкую корку. При нагревании с водородом и металлами активной группы восстанавливается до марганца. Имеет зеленый и серо-зеленый цвет кристаллов. Полупроводник.
Оксид марганца (II,III). Кристаллы коричневого – черного цвета Mn3O4. Парамагнетик. В естественной среде встречается как минерал гаусманит.
Оксид марганца (II,IV). Соединение неорганического хаpaктера Mn5O8. Может рассматриваться как ортоманганит марганца. Не растворяется в H2O.
Оксид марганца (III).Кристаллы коричневого – черного цвета Mn2O3. Не вступают в реакцию с водой. Встречается в природной среде в минералах браунит, курнакит и биксбиит.
Оксид марганца (IV) или диоксид марганца MnO2. Нерастворимый в воде порошок темно-коричневого оттенка. Устойчивое образование марганца. Содержится в минерале пиролюзит. Поглощает хлор и соли тяжелых металлов.
Оксид марганца (VI) . Темно-красный аморфный элемент. Вступает в реакцию с водой. Полностью разлагается при нагревании. Щелочные реакции образуют солевые отложения.
Оксид марганца (VII). Маслянистая зеленовато-бурая жидкость Mn2O7. Сильный окислитель. При контакте с горючими смесями, мгновенно воспламеняет их. Может взорваться от толчка, резкой и яркой вспышки света, взаимодействия с органическими компонентами. При взаимодействии с Н2O образует марганцовую кислоту.
Соли марганца являются катализаторами окислительных процессов, происходящих с участием кислорода. Они применяются в сиккативах. Льняное масло с добавлением такого сиккатива именуется олифой.
Применение марганца
Mn широко используют в черной металлургии. Добавляют сплав железо марганец (ферромарганец). Доля марганца в нем равна 70-80%, углерода 0,5-7 %, остальная часть приходится на железо и посторонние примеси. Элемент №25 в сталеплавлении соединяет кислород и серу.
Используются смеси хром — марганец, вольфрам -марганец, кремний-марганец. В производстве стали марганцу альтернативной замены нет.
Химический элемент выполняет множество функций, в том числе рафинирует и раскисляет сталь. Широко используется технология цинк марганец. Растворимость Zn в магнии составляет 2 %, а прочность стали, в этом случае, возрастает до 40 %.
В доменной шахте марганец удаляет серный налет из чугуна. В технике применяются тройные сплавы манганины, куда входит марганец медь и никель. Материал хаpaктеризуется большим электро-сопротивлением на которое влияет не температура, а сила давления.
Используется для изготовления манометров. Настоящей ценностью для промышленности является сплав медь — марганец. Содержание марганца здесь 70 %, меди 30%. Его применяют для снижения вредных производственных шумов. В изготовлении взрыв-пакетов для праздничных мероприятий используют смесь, куда входят такие элементы, как магний марганец. Магний широко используется в самолетостроении.
Некоторые виды солей марганца, такие как KMnO4 нашли свое применение в медицинской отрасли. Перманганат калия относится к солям марганцовой кислоты. Имеет вид темно-фиолетовых кристаллов . Растворяется в водной среде, окрашивая её в фиолетовый цвет.
Является сильным окислителем. Антисептик, обладает противомикробными свойствами. Марганец в воде легко окисляется, образуя плохо растворимый оксид марганца коричневого цвета.
При соприкосновении с белком ткани формирует соединения с выраженными вяжущими качествами. В высоких концентрациях раствор марганца обладает раздражающим и прижигающим действием.
Калий марганец используют для лечения некоторых заболеваний и для оказания первой помощи, а пузырек с кристаллами марганцовки находится в каждой аптечки.
Марганец полезен для человеческого здоровья. Участвует в формировании и развитии клеток центрально-нервной системы. Способствует усвоению витамина В1, меди и железа. Регулирует содержание сахара в крови. Задействуется в строительстве костной ткани.
Участвует в образовании жирных кислот. Улучшает рефлекторные способности, память, убирает нервное напряжение, раздражительность. Абсорбируясь в стенках кишечника марганец, витамины В, Е, фосфор, кальций усиливают этот процесс, влияет на организм и обменные процессы в целом.
Минералы, незаменимые для человека, такие как кальций, магний, марганец, медь, калий, железо добавляют в витаминно-минеральные комплексы для устранения витаминного дефицита.
Читать еще: Эффективен ли хитозан для похудения? ОтзывыТакже микроэлементы цинк, марганец и железо играют огромную роль в жизни растений. Входят в состав фосфорных и минеральных удобрений.
Цена марганца
Металлический марганец содержит до 95 % чистого марганца. Его применяют в сталелитейной металлургической промышленности. Удаляет из стали ненужные примеси и наделяет её легирующими качествами.
Ферромарганец используется для раскисления сплава во время процесса плавления, путем удаления из него кислорода. Связывает частицы серы между собой, улучшая качественные хаpaктеристики стали. Марганец упрочняет материал, делает его более износостойким.
Применяют металл при создании шаровых мельниц, землеройных и камнедробильных машин, броневых элементов. Из сплава мангадин изготавливают реостаты. Элемент № 25 добавляют в бронзу и латунь .
Большой процент диоксида марганца потрeбляется для создания гальванических элементов. Сплав с добавлением Mn задействуется в тонком органическом и промышленном синтезе. Соединения MnO2 и KMnO4 выступают окислителями.
Марганец – вещество незаменимое в черной металлургии. Уникален по своим физическим и химическим хаpaктеристикам. Марганец купить можно в специализированных торговых точках. Пять килограмм металла стоит порядка 150 рублей, а тонна, в зависимости вида соединения, стоит около 100-200 тысяч рублей.
Марганец: сплавы, свойства, распространение
Марганец – химический элемент с атомной массой 54,9380 и атомным номером 25, серебристо-белого оттенка, с большой массой, в природе существует в виде стабильного изотопа 35 Мn. Первые упоминания о металле записал древнеримский ученый Плиний, называл его «черным камнем». В те времена марганец использовался в качестве осветлителя стекла, во время процесса варки в расплав добавлялся пиролюзит марганца МnО2.
В Грузии издавна пиролюзит марганца использовался как присадка во время получения железа, назывался черной магнезией и считался одной из разновидностей магнетита (магнитного железняка). Лишь в 1774 году шведским ученым Шееле было доказано, что это соединение неизвестного науке металла, а через несколько лет Ю. Ган во время нагревания смеси угля и пиролюзита получил первый марганец, загрязненный атомами углерода.
Природное распространение марганца
В природе химический элемент марганец малораспространен, в земной коре его содержится всего 0,1%, в вулканической лаве 0,06–0,2%, металл на поверхности в рассеянном состоянии, имеет форму Мn 2+ . На поверхности земли под воздействием кислорода быстро образуются окислы марганца, имеют распространение минералы Мn 3+ и Мn 4+ , в биосфере металл малоподвижен в окислительной среде. Марганец – химический элемент, активно мигрирует при наличии восстановительных условий, металл очень подвижен в кислых природных водоемах тундры и лесных ландшафтах, где преобладает окислительная среда. По этой причине культурные растения имеют избыточное содержание металла, в почвах образуются железомарганцевые конкреции, болотные и озерные низкопроцентные руды.
В регионах с сухим климатом преобладает щелочная окислительная среда, что ограничивает подвижность металла. В культурных растениях ощущается недостаток марганца, сельхозпроизводство не может обходиться без использования специальных комплексных микродобавок. В реках химический элемент малораспространен, но суммарный вынос может достигать больших величин. Особенно много марганца имеется в прибрежных зонах в виде естественных осадков. На дне океанов встречаются большие залежи металла, которые образовались в давние геологические периоды, когда дно было сушей.
Химические свойства марганца
Марганец относится к категории активных металлов, при повышенных температурах активно вступает в реакции с неметаллами: азотом, кислородом, серой, фосфором и другими. В результате образуются разновалентные окислы марганца. При комнатной температуре марганец химический элемент малоактивен, при растворении в кислотах образует двухвалентные соли. При нагреве в вакууме до высоких температур химический элемент способен испаряться даже из устойчивых сплавов. Соединения марганца во многом схожи с соединениями железа, кобальта и никеля, находящихся в такой же степени окисления.
Наблюдается большое сходство марганца с хромом, подгруппа металла также имеет повышенную устойчивость при высших степенях окисления при увеличении порядкового номера элемента. Перенаты являются менее сильными окислителями, чем перманганаты.
Исходя из состава соединений марганца (II) допускается образование металла с более высокими степенями окисления, такие превращения могут происходить как в растворах, так и в расплавах солей.
Стабилизация степеней окисления марганца Существование большого числа степеней окисления у марганца химического элемента объясняется тем, что в переходных элементах во время образования связей с d-орбиталями их энергетические уровни расщепляются при тетраэдрическом, октаэдрическом и квадратном размещении лигандов. Ниже приводится таблица известных в настоящее время степеней окисления некоторых металлов в первом переходном периоде.
Обращают на себя внимание низкие степени окисления, которые встречаются в большом ряде комплексов. В таблице есть перечень соединений, в которых лигандами являются химически нейтральные молекулы CO, NO и другие.
За счет комплексообразования стабилизируются высокие степени окисления марганца, самыми подходящими для этого лигандами является кислород и фтор. Если принимать во внимание, что стабилизирующее координационное число равняется шести, то максимальная стабилизация равняется пяти. Если марганец химический элемент образует оксокомплексы, то могут стабилизироваться более высокие степени окисления.
Фторо- и оксокомплексы
Стабилизация марганца в низших степенях окисления
Теория мягких и жестких кислот и оснований дает возможность объяснить стабилизацию разных степеней окисления металлов за счет комплексообразования при воздействии с лигандами. Элементы мягкого типа успешно стабилизируют невысокие степени окисления металла, а жесткие положительно стабилизируют высокие степени окисления.
Теория полностью объясняет связи металл-металл, формально эти связи рассматриваются как кислотно-основное взаимное воздействие.
Сплавы марганца Активные химические свойства марганца позволяют ему образовывать сплавы со многими металлами, при этом большое количество металлов может растворяться в отдельных модификациях марганца и стабилизировать его. Медь, железо, кобальт, никель и некоторые другие металлы способны стабилизировать γ-модификацию, алюминий и серебро способны расширять β- и σ-области магния в двойных сплавах. Эти хаpaктеристики играют важную роль металлургии. Марганец химический элемент позволяет получать сплавы и высокими значениями пластичности, они поддаются штамповке, ковке и прокату.
В химических соединениях валентность марганца изменяется в пределах 2–7, увеличение степени окисления становится причиной возрастания окислительных и кислотных хаpaктеристик марганца. Все соединения Mn(+2) относятся к восстановителям. Оксид марганца имеет восстановительные свойства, серо-зеленого цвета, в воде и щелочах не растворяется, зато отлично растворяется в кислотах. Гидроксид марганца Mn(OH)3 в воде не растворяется, по цвету белое вещество. Образование Mn(+4) может быть и окислителем (а), и восстановителем (б).
Эта реакция используется при необходимости получения в лабораторных условиях хлора.
Реакция протекает при сплавлении металлов. MnO2 (оксид марганца) имеет бурый цвет, соответствующий гидроксид по цвету несколько темнее.
Физические свойства марганца Марганец – химический элемент с плотностью 7,2–7,4 г/см 3 , t° плавления +1245°С, закипает при температуре +1250°С. Металлу присущи четыре полиморфные модификации:
- α-Мn. Имеет кубическую объемно-центрированную решетку, в одной элементарной ячейке располагается 58 атомов.
- β-Мn. Имеет кубическую объемно-центрированную решетку, в одной элементарной ячейке располагается 20 атомов.
- γ-Мn. Имеет тетрагональную решетку, в одной ячейке 4 атома.
- δ-Mn. Имеет кубическую объемно-центрированную решетку.
Температуры превращений марганца: α=β при t°+705°С; β=γ при t°+1090°С; γ=δ при t°+1133С. Наиболее хрупкая модификация α, в металлургии используется редко. Самыми значительными показателями пластичности отличается модификация γ, она чаще всего используется в металлургии. β-модификация частично пластична, промышленность ее применяет редко. Атомный радиус марганца химического элемента составляет 1,3 А, ионные радиусы в зависимости от валентности колeблются в пределах 0,46–0,91. Марганец парамагнитен, коэффициенты теплового расширения 22,3×10 -6 град -1 . Физические свойства могут немного корректироваться в зависимости от чистоты металла и его фактической валентности.
Способ получения марганца Современная промышленность получает марганец по методу, разработанному электрохимиком В. И. Агладзе путем электрогидролиза водных растворов металла при добавлении (NH4)2SO4, во время процесса кислотность раствора должна быть в пределах рН = 8,0–8,5. В раствор погружаются свинцовые аноды и катоды из сплава на основе титана АТ-3, допускается замена титановых катодов нержавеющими. Промышленность использует порошок марганца, который после окончания процесса снимается с катодов, металл оседает в виде чешуек. Способ получения считается энергетически затратным, это оказывает прямое влияние на увеличение себестоимости. При необходимости собранный марганец в дальнейшем переплавляется, что позволяет облегчить его применение в металлургии.
Марганец – химический элемент, который можно получать и галогенным процессом за счет хлорирования руды и дальнейшим восстановлением образовавшихся галогенидов. Такая технология обеспечивает промышленность марганцем с количеством посторонних технологических примесей не более 0,1%. Более загрязненный металл получают при протекании алюмотермической реакции:
Или электротермией. Для удаления вредных выбросов в производственных цехах монтируется мощная принудительная вентиляция: воздуховоды из ПВХ, вентиляторы центробежного принципа действия. Кратность обмена воздуха регламентируется нормативными положениями и должна обеспечивать безопасное пребывание людей в рабочих зонах.
Использование марганца Главный потребитель марганца – черная металлургия. Широкое использование металл имеет и в фармацевтической промышленности. На одну тонну выплавляемой стали необходимо 8–9 килограмм, перед введением в сплав марганца химического элемента его предварительно сплавляют с железом для получения ферромарганца. В сплаве доля марганца химического элемента составляет до 80%, углерода до 7%, остальное количество занимает железо и различные технологические примеси. За счет использования добавок значительно повышаются физико-механические хаpaктеристики сталей, выплавляемых в доменных печах. Технология пригодна и для использования добавок в современных электрических сталелитейных печах. За счет добавок высокоуглеродистого ферромарганца происходит раскисление и десульфарация стали. При добавке средне- и малоуглеродистых ферромарганцев металлургия получает легированные стали.
Низколегированная сталь имеет в составе 0,9–1,6% марганца, высоколегированная до 15%. Высокими показателями физической прочности и антикоррозионной устойчивости обладает сталь с содержанием 15% марганца и 14% хрома. Металл износоустойчив, может работать в жестких температурных условиях, не боится прямого контакта с агрессивными химическими соединениями. Такие высокие хаpaктеристики позволяют использовать сталь для изготовления наиболее ответственных конструкций и промышленных агрегатов, работающих в сложных условиях.
Марганец – химический элемент, применяемый и во время выплавки сплавов на безжелезной основе. Во время производства высокооборотных лопаток промышленных турбин используется сплав меди с марганцем, для пропеллеров применяются бронзы с содержанием марганца. Кроме этих сплавов, марганец как химический элемент присутствует в алюминиевых и магниевых. Он намного улучшает эксплуатационные хаpaктеристики цветных сплавов, делает их хорошо деформируемыми, не боящимися коррозионных процессов и износостойкими.
Легированные стали являются основным материалом для тяжелой промышленности, незаменимы во время производства различных типов вооружений. Широко применяются в кораблестроении и самолетостроении. Наличие стратегического запаса марганца – условие высокой обороноспособности любого государства. В связи с этим добыча металла ежегодно увеличивается. Кроме того, марганец – химический элемент, применяемый во время производства стекла, в сельском хозяйстве, полиграфии и т. д.
Марганец в флоре и фауне
В живой природе марганец – химический элемент, играющий важную роль в развитии. Он влияет на хаpaктеристики роста, состав крови, интенсивность процесса фотосинтеза. В растениях его количество составляет десятитысячные доли процента, а в животных стотысячные доли процента. Но даже такое незначительное содержание оказывает заметное влияние на большинство их функций. Он активирует воздействие ферментов, влияет на функцию инсулина, минеральный и кроветворный обмен. Недостаток марганца становится причиной появления различных болезней как острых, так и хронических.
Марганец – химический элемент, широко используемый в медицине. Недостаток марганца понижает физическую выносливость, становится причиной некоторых видов анемий, нарушает обменные процессы в костных тканях. Широко известны дезинфицирующие хаpaктеристики марганца, его растворы используются во время обработки некрозных тканей.
Недостаточное количество марганца в пище животных становится причиной снижения ежесуточного привеса. Для растений такая ситуация становится причиной пятнистости, ожогов, хлорозов и других заболеваний. При обнаружении признаков отравления назначается специальная медикаментозная терапия. Сильное отравление может становиться причиной появления синдрома марганцевого паркинсонизма – трудноизлечимой болезни, оказывающей негативное влияние на центральную нервную систему человека.
Суточная потребность марганца составляет до 8 мг, главное количество человек получает с пищей. При этом рацион должен быть сбалансированным по всем питательным веществам. При увеличенной нагрузке и недостаточном количестве солнечного света доза марганца корректируется на основании общего анализа крови. Значительное количество марганца содержится в грибах, водяных орехах, ряске, моллюсках и paкообразных. Содержание марганца в них может достигать нескольких десятых процента.
При попадании марганца в организм в чрезмерных дозах могут возникать болезни мышечных и костных тканей, поражаются дыхательные пути, страдает печень и селезенка. Для выведения марганца из организма требуется много времени, за этот период токсические хаpaктеристики увеличиваются с эффектом накапливания. Допустимая санитарными органами концентрация марганца в воздушной среде должна быть ≤ 0,3 мг/м 3 , контроль параметров выполняется в специальных лабораториях путем отбора воздуха. Алгоритм отбора регулируется государственными нормативными актами.
Марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой. Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом.
Серебристо-белый цвет с легким серым налетом выделяет марганец. Он превосходит железо по твердости и хрупкости. Является парамагнетиком. При взаимодействии с воздушной средой происходит окисление марганца. Покрывается оксидной пленкой, защищающей его от последующей окислительной реакции.
Растворяется в воде, полностью поглощает водород, не вступая в реакцию с ним. В процессе нагревания сгорает в кислороде. Активно реагирует с хлором и серой. При взаимодействии с кислотными окислителями образует соли марганца.
Плотность — 7200 кг/м 3 , t плавления — 1247°С, t кипения — 2150 °С. Удельная теплоемкость — 0,478 кДж. Обладает электрической проводимостью. Контактируя с хлором, бромом и йодом образует дигалогениды.
При высоких температурах вступает во взаимодействие с азотом, фосфором, кремнием и бором. Медленно взаимодействует с холодной водой. В процессе нагревания реакционная способность элемента возрастает. На выходе образуется Mn(OH)2 и водород.
ЗАПАСЫ И ДОБЫЧА
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7—10−6%), а в глубоких местах океана его концентрация возрастает до 0,3 %.
Промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление).
ПРОИСХОЖДЕНИЕ
Вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
ПРИМЕНЕНИЕ
Марганец широко используют в черной металлургии. Добавляют сплав железо марганец (ферромарганец). Доля марганца в нем равна 70-80%, углерода 0,5-7 %, остальная часть приходится на железо и посторонние примеси. Элемент №25 в сталеплавлении соединяет кислород и серу.
Используются смеси хром — марганец, вольфрам-марганец, кремний-марганец. В производстве стали марганцу альтернативной замены нет.
Химический элемент выполняет множество функций, в том числе рафинирует и раскисляет сталь. Широко используется технология цинк марганец. Растворимость Zn в магнии составляет 2 %, а прочность стали, в этом случае, возрастает до 40 %.
В доменной шахте марганец удаляет серный налет из чугуна. В технике применяются тройные сплавы манганины, куда входит марганец медь и никель. Материал хаpaктеризуется большим электро-сопротивлением на которое влияет не температура, а сила давления.
Используется для изготовления манометров. Настоящей ценностью для промышленности является сплав медь — марганец. Содержание марганца здесь 70 %, меди 30%. Его применяют для снижения вредных производственных шумов. В изготовлении взрыв-пакетов для праздничных мероприятий используют смесь, куда входят такие элементы, как магний марганец. Магний широко используется в самолетостроении.
Некоторые виды солей марганца, такие как KMnO4 нашли свое применение в медицинской отрасли. Перманганат калия относится к солям марганцовой кислоты. Имеет вид темно-фиолетовых кристаллов. Растворяется в водной среде, окрашивая её в фиолетовый цвет. Является сильным окислителем. Антисептик, обладает противомикробными свойствами. Марганец в воде легко окисляется, образуя плохо растворимый оксид марганца коричневого цвета. При соприкосновении с белком ткани формирует соединения с выраженными вяжущими качествами. В высоких концентрациях раствор марганца обладает раздражающим и прижигающим действием. Калий марганец используют для лечения некоторых заболеваний и для оказания первой помощи, а пузырек с кристаллами марганцовки находится в каждой аптечки.
Марганец полезен для человеческого здоровья. Участвует в формировании и развитии клеток центрально-нервной системы. Способствует усвоению витамина В1, меди и железа. Регулирует содержание сахара в крови. Задействуется в строительстве костной ткани.
Участвует в образовании жирных кислот. Улучшает рефлекторные способности, память, убирает нервное напряжение, раздражительность. Абсорбируясь в стенках кишечника марганец, витамины В, Е, фосфор, кальций усиливают этот процесс, влияет на организм и обменные процессы в целом.
Марганец: основные хаpaктеристики, производство и применение вещества
Минералы марганца, в частности пиролюзит, известны были еще в античные времена. Считали пиролюзит разновидностью магнитного железняка и использовали при варке стекла – для осветления. То, что минерал в отличие от настоящего магнитного железняка магнитом не притягивается, объясняли довольно занятно: полагали, что пиролюзит – минерал женского пола и к магниту равнодушен.
В 18-м веке марганец выделили в чистом виде. И сегодня мы поговрим о нем детально. Так, обсудим, вреден ли чем опасен марганец, где его можно купить, как получить марганец и подчиняется ли он ГОСТу.
Что такое марганец
Марганец относится к подобной группе 7 группы 4 периода. Элемент является распространенным – занимает 14 место.
Элемент относится к тяжелым металлам – атомная масса более 40. На воздухе пассивируется – покрывается плотной оксидной пленкой, препятствующей дальнейшей реакции с кислородом. Благодаря этой пленке в нормальных условиях малоактивен.
Читать еще: Какие можно есть макароны при похудении — четко, по темеПри нагревании марганец вступает в реакцию с множеством простых веществ, кислот и оснований, образуя соединения с самой разной степенью окисления: -1, -6, +2, +3, +4, +7. Металл относится к переходным, поэтому с равной легкостью проявляет и восстановительные, и окислительные свойства. С металлами, например, с железом, образует твердые растворы, не вступая в реакцию.
Данное видео расскажет о том, что такое марганец:
Особенности и отличия от других материалов
Марганец – серебристо-белый металл, плотный, твердый – тверже железа, с необыкновенно сложной структурой. Последняя является причиной хрупкости вещества. Известны 4 модификации марганца. Сплавы с металлом позволяют стабилизировать любую из них и получить твердые растворы с очень разными свойствами.
- Марганец относится к числу жизненно важных микроэлементов. Причем в равной степени это относится и к растениям, и к животным. Элемент участвует в фотосинтезе, в процессе дыхания, активирует ряд ферментов, является непременным участником мышечного метаболизма и так далее. Суточная доза марганца для человека составляет 2– 9 мг. Одинаково опасен как недостаток, так и избыток элемента.
- Металл тяжелее и тверже железа, однако пpaктического применения в чистом виде не имеет из-за высокой хрупкости. Но его сплавы и соединения имеют необыкновенно большое значение в народном хозяйстве. Он используется в черной и цветной металлургии, в производстве удобрений, в электротехнике, в тонком органическом синтезе и так далее.
- От металлов своей собственной подгруппы марганец довольно сильно отличается. Технеций – радиоактивный элемент, получен искусственно. Рений относит к рассеянным и редким элементам. Борий также может быть получен только искусственным путем и в природе не встречается. Химическая активность и технеция и рения намного ниже, чем у марганца. Пpaктическое применение, если не считать ядерного синтеза, находит только марганец.
Плюсы и минусы
Физические и химические свойства металла таковы, что на пpaктике дело имеют не с самим марганцем, а с его многочисленными соединениями и сплавами, так что достоинства и недостатки материала стоит рассматривать с этой точки зрения.
- Марганец образует самые разнообразные сплавы пpaктически со всеми металлами, что является несомненным плюсом.
- Железо и марганец полностью взаиморастворимы, то есть, образуют твердые растворы с любым соотношением элементом, однородные по свойствам. При этом сплав будет иметь куда более низкую температуру кипения, чем у марганца.
- Наибольшее пpaктическое значение имеют сплавы элемента с углеродом и кремнием. Оба сплава имеют огромное значение для сталелитейной промышленности.
- Многочисленные и разнообразные соединения марганца применяют в химической, текстильной, стекольной промышленности, при производстве удобрений и так далее. Основой такого разнообразия служит химическая активность вещества.
Недостатки металла связаны с особенностями его строения, не позволяющими использовать сам металл в качестве конструкционного материала.
- Главный из них – хрупкость при высокой твердости. Mn до +707 С кристаллизируется в структуре, где ячейка включает 58 атомов.
- Довольно высокая температура кипения, работать с металлом со столь высокими показателями тяжело.
- Электропроводность марганца очень низкая, так что применение его в электротехнике тоже ограничено.
Про химические и физические свойства марганца поговорим далее.
Свойства и хаpaктеристики
Физические хаpaктеристики металла заметно зависят от температуры. Учитывая наличие целых 4 модификаций это неудивительно.
Основные хаpaктеристики вещества таковы:
- плотность – при нормальной температуре составляет 7,45 г/куб. см. Именно эта величина слабо зависит от температуры: так, при нагревании до 600 С плотность уменьшается только на 7%;
- температура плавления – 1244 С;
- температура кипения – 2095 С;
- теплопроводность при 25 С составляет 66,57 Вт/(м·К), что для металла является низким показателем;
- удельная теплоемкость – 0,478 кДж/(кг·К) ;
- коэффициент линейного расширения, измеренный при 20 С, равен 22,3·10 -6 град -1 — ; Теплоемкость и теплопроводность вещества увеличиваются линейно при увеличении температуры;
- удельное электрическое сопротивление – 1,5– 2,6 мком·м , лишь немногим выше, чем у свинца.
Структура и состав марганца описаны ниже.
Марганец и его соединения — тема видеоролика ниже:
Структура и состав
Описаны 4 структурные модификации вещества, каждая из которых устойчива в определенном температурном интервале. Сплавление с определенными металлами может стабилизировать любую фазу.
- До 707 С устойчивой является а-модификация. – кубическая объемно-центрированная решетка, в состав элементарной ячейки которой входит 58 атомов. Такая структура очень сложна и обуславливает высокую хрупкость вещества. Его показатели – теплоемкость, теплопроводность, плотность, приводятся как свойства вещества.
- При 700–1079 С устойчивой является b-фаза с таким же типом решетки, но с более простым строением: ячейку составляет 20 атомов. В этой фазе марганец проявляет определенную пластичность. Плотность b-модификации – 7,26 г/куб. см. Фазу легко зафиксировать – закалкой вещества при температуре выше температуры фазового перехода.
- При температурах от 1079 С до 1143 С g-фаза стабильна. Для нее хаpaктерна кубическая гранецентрированная решетка с ячейкой из 4 атомов. Модификация отличается пластичностью. Однако зафиксировать фазу полностью при охлаждении не удается. При температуре перехода плотность металла составляет 6,37 г/куб. см, при нормальной – 7, 21 г/куб. см.
- Выше температуры 1143 С и до кипения стабилизируется d-фаза с объемно-центрированной кубической решеткой, ячейка которой включает 2 атома. Плотность модификации составляет 6,28 г/куб. см. Интересно то, что d-Mn может перейти в антиферромагнитное состояние при высокой температуре – 303 С.
Фазовые переходы имеют большое значение при получении разнообразных сплавов, тем более что физические хаpaктеристики структурных модификаций отличаются.
Производство марганца описано ниже.
Производство
В основном марганец сопровождает железо в его рудах, но встречаются и самостоятельные месторождения. Так, на территории чиатурского месторождения сконцентрировано до 40% мирового запаса марганцевых руд.
Элемент рассеян едва ли не во всех горных породах, легко вымывается. Содержание его в морской воде невелико, но на дне океанов он формирует вместе с железом конкреции, в которых содержания элемента достигает 45%. Эти залежи считают перспективными для дальнейшего разpaбатывания.
Самые известные минералы: пиролюзит, магнитит, браунит, марганцевый шпат и так далее. Содержание элемента в них варьируется от 62 до 69%. Добываются карьерным или шахтным способом. Как правило, руда предварительно обогащается.
Получение марганца напрямую связано с его применением. Главный его потребитель – сталелитейная промышленность, а для ее нужд требуется не сам металл, а его соединение с железом – ферромарганец. Поэтому говоря о получении марганца, зачастую имеют в виду соединение, необходимое в черной металлургии.
Ранее ферромарганец производился в доменных печах. Но из-за дефицита кокса и необходимости использовать бедные марганцовые руды производители перешли к выплавке в электропечах.
Для плавки используются открытые и закрытые печи, футерованные углем – таким образом получают углеродистый ферромарганец. Плавку производят при напряжении в 110–160 В, двумя методами – флюсовым и бесфлюсовым. Второй метод более экономичен, так как позволяет полнее извлечь элемент, однако при большом содержании кремнезема в руде, возможен только флюсовый способ.
- Бесфлюсовый метод – непрерывный процесс. Шихта из марганцевой руды, кокса и железной стружки загружается по мере переплавления. Важно следить за достаточным количеством восстановителя. Ферромарганец и шлак выпускаются одновременно 5–6 раз за смену.
- Силикомарганец производят сходным методом в электроплавильной печи. Шихта, кроме руды включает марганцевый шлак – без фосфора, кварцит и коксик.
- Металлический марганец получают аналогично выплавке ферромарганца. Сырьем служат отходы от разливки и разделки сплава. После расплавления сплава и шихты добавляют силикомарганец, а за 30 минут до окончания плавки продувают сжатым воздухом.
- Химически чистое вещество получают электролизом.
Применение
90% мировой добычи марганца уходит на нужды сталелитейной промышленности. Причем большинство металлов требуется не для получения собственно марганцевых сплавов, а для производства чугуна и стали как таковых.
- Свойства стали сильно зависит от тех или иных примесей, но если легирующие элементы вводятся специально для улучшения свойств сплава, то примеси кислорода и серы являются нежелательными. Ферромарганец и есть то соединение, которое участвует при выплавке стали и чугуна в качестве раскислителя и десульфатора. Во время плавки марганец связывает кислород и серу, тем самым уменьшая в готовом изделии их содержание.
- Кроме того, марганец сам по себе используется в качестве легирующего элемента. Так, нержавеющая сталь помимо хрома и никеля включает 1% элемента. Более того, он может полностью заместить никель, если повысить его содержание до 4–16%. Дело в том, что марганец как и никель стабилизирует в стали фазу аустенита.
- Марганец способен заметно понизить температуру перехода аустенита в феррит, что предупреждает осаждение карбида железа. Таким образом готовый продукт приобретает большую жесткость и прочность.
- Элемент марганец применяют для получения стойких к коррозии алюминиевых сплавов – от 1 %. Такой материал применяется в пищеобpaбатывающей промышленности при изготовлении самой разной тары. Сплавы металла с медью – марганцовистая бронза, используются при изготовлении морских винтов, подшипников, шестерней и других деталей, контактирующих с морской водой.
- Соединения его очень широко используются в неметаллургической промышленности – в медицине, в сельском хозяйстве, на химических производствах.
Марганец – металл, который интересен не столько сам по себе, сколько свойствами своих многочисленных соединений. Однако переоценить его значение в качестве легирующего элемента сложно.
Реакция оксида марганца с алюминием продемонстрирована в этом видео:





 Как ухаживать за подростковой кожей
Как ухаживать за подростковой кожей  Бессимптомная (скрытая) пневмония: симптомы и лечение
Бессимптомная (скрытая) пневмония: симптомы и лечение  Лечение волос луком – просто и эффективно!
Лечение волос луком – просто и эффективно!  Как проходят вторые роды: особенности и отличия от первых
Как проходят вторые роды: особенности и отличия от первых  Детский шампунь
Детский шампунь  Приметы о собаках — полный разбор всех суеверий, связанных с собаками
Приметы о собаках — полный разбор всех суеверий, связанных с собаками  Вероятность зачатия при пpeдoxpaнении
Вероятность зачатия при пpeдoxpaнении  Что такое окклюзионная повязка и в каких случаях она применяется?
Что такое окклюзионная повязка и в каких случаях она применяется?  Отравление и передозировка болиголовом
Отравление и передозировка болиголовом  Понятие окружности грудной клетки
Понятие окружности грудной клетки  Тройчатка от температуры состав для детей пропорции
Тройчатка от температуры состав для детей пропорции  Как измерить давление без тонометра
Как измерить давление без тонометра  Демпинг-синдром
Демпинг-синдром  Список транквилизаторов, которые продают без рецептов врачей
Список транквилизаторов, которые продают без рецептов врачей  Можно ли заниматься иHTиMной близостью во время мeнcтpуации?
Можно ли заниматься иHTиMной близостью во время мeнcтpуации?  Заменитель какао масла лауринового типа: польза и вред
Заменитель какао масла лауринового типа: польза и вред